Uso de probióticos como promotor de crescimento em piscicultura de espécies nativas
Nos últimos anos a aquicultura faz uso dos aditivos e suplementos, nas dietas de peixes e camarões, como ferramenta alimentar que proporciona melhor eficiência na absorção dos nutrientes, com o intuito de obter o melhor desempenho zootécnico. Entretanto, seu uso vai além desse benefício e deverá, consequentemente, refletir na saúde e bem-estar dos animais produzidos em cativeiro.
A aquicultura atual tem como propósito aumentar sua produtividade em paralelo ao aprimoramento sustentável dos cultivos.
![]() Entretanto, a intensificação nos ciclos produtivos e o aumento na densidade de peixes por área útil gera condições estressantes aos animais, porém, o uso de aditivos/suplementos alimentares é capaz de atenuar os prejuízos decorrentes dos estímulos adversos da criação, promovendo, por exemplo, estímulos para o sistema imune e na fisiologia do organismo, além do melhor desempenho produtivo.
Entretanto, a intensificação nos ciclos produtivos e o aumento na densidade de peixes por área útil gera condições estressantes aos animais, porém, o uso de aditivos/suplementos alimentares é capaz de atenuar os prejuízos decorrentes dos estímulos adversos da criação, promovendo, por exemplo, estímulos para o sistema imune e na fisiologia do organismo, além do melhor desempenho produtivo.
E QUAL A DIFERENÇA ENTRE ADITIVO E SUPLEMENTO ALIMENTAR EM NUTRIÇÃO ANIMAL?
Os aditivos são considerados qualquer substância intencionalmente adicionada ao alimento, com a finalidade de conservar, intensificar ou modificar suas propriedades, desde que não prejudique o seu valor nutritivo (Decreto 76.986 de 06 de janeiro de 1976, Brasil).
Segundo Cavalheiro et al. (2014), podem ser classificados de acordo com suas funções e propriedades em:
![]() Tecnológicos
Tecnológicos
![]() Sensoriais
Sensoriais
![]() Nutricionais
Nutricionais
![]() Zootécnicos
Zootécnicos
![]() Anticoccidianos, e ainda serem incluídos em uma ou mais destas categorias.
Anticoccidianos, e ainda serem incluídos em uma ou mais destas categorias.
Já os suplementos alimentares, podem ser caracterizados como uma mistura composta por ingredientes ou aditivos, podendo conter veículo ou excipiente, que deve ser fornecido diretamente ao animal ou indicado para diluição com o objetivo de melhorar o balanço nutricional e o desenvolvimento dos animais; ou seja, complementar a alimentação animal de acordo com suas necessidades, podendo estas serem transitórias ou não (Instrução Normativa 15/2009/MAPA).
| N |
![]()
O termo probiótico é caracterizado como “microrganismos vivos que produzem efeitos úteis sobre o hospedeiro, modificando os padrões associados ou comunidade de microrganismos, proporcionando uma melhor absorção das rações ou aumentando seu valor nutricional e, consequentemente, melhorando a resposta do hospedeiro à doença e ainda aumentando a qualidade microbiológica do ambiente exposto” (Ibrahem, 2015).
O estabelecimento das bactérias probióticas na mucosa intestinal do hospedeiro ocorre nas etapas de atração aos sítios de adesão, em seguida, ocorre a secreção de substância de ligação favorecendo a associação das bactérias não patogênicas e finalmente a ligação das células ao tecido (Balcazar et al., 2007).
 Na nutrição animal, em especial de peixes, a introdução de bactérias probióticas via alimentação torna-se uma ferramenta benéfica para manter o crescimento e funções normais dos animais aquáticos, auxiliando na melhor absorção de nutrientes, vitaminas e atividades digestivas pela atuação de enzimas, apresentando efeito positivo sobre a utilização de alimentos, e consequentemente, no desempenho dos animais (Dawood et al., 2015; Nath et al., 2018) (Figura 1).
Na nutrição animal, em especial de peixes, a introdução de bactérias probióticas via alimentação torna-se uma ferramenta benéfica para manter o crescimento e funções normais dos animais aquáticos, auxiliando na melhor absorção de nutrientes, vitaminas e atividades digestivas pela atuação de enzimas, apresentando efeito positivo sobre a utilização de alimentos, e consequentemente, no desempenho dos animais (Dawood et al., 2015; Nath et al., 2018) (Figura 1).
Segundo Kiron (2015), para obtenção de benefício direto no animal alvo, no caso em peixes, os microrganismos inócuos devem ser administrados via ração.
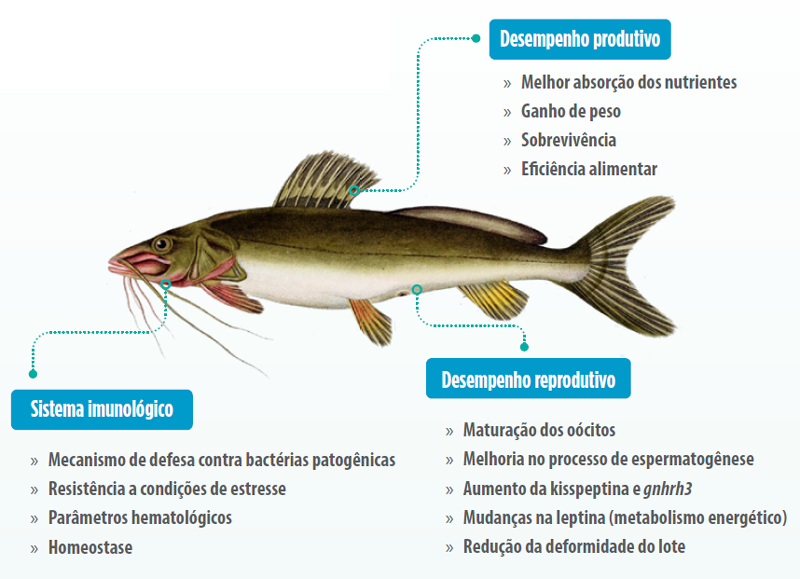
Figura 1. Mecanismos de ação do probiótico nos peixes e sua relação com os sistemas: imunológico, nutricional e fisiológico (desempenho produtivo e reprodutivo).
Ilustração adaptada de Rhamdia quelen.
Fonte: Companhia energética de São Paulo, 2006.
Ressalta-se a importância das bactérias probióticas pela otimização do ambiente de produção, devido aos múltiplos usos da água de cultivo, que além de servir para manutenção vital de processos metabólicos (respiração), consiste também no local de disposição do alimento e depósito das excretas dos animais e, consequentemente, influenciando na homeostase dos peixes.
MICROBIOTA INTESTINAL DE PEIXES[registrados]
 Nos organismos aquáticos a composição da microbiota intestinal possui relação direta com o ambiente a que está integrado, logo, com a microbiota da água do sistema de cultivo, podendo ainda sofrer alteração por influência de propriedades físicas, químicas e biológicas (Silva et al., 2005; Paixão et al., 2016).
Nos organismos aquáticos a composição da microbiota intestinal possui relação direta com o ambiente a que está integrado, logo, com a microbiota da água do sistema de cultivo, podendo ainda sofrer alteração por influência de propriedades físicas, químicas e biológicas (Silva et al., 2005; Paixão et al., 2016).
No ambiente de cultivo, ocorre uma interação entre as células bacterianas do hospedeiro e ambiente por compartilharem o mesmo sistema ecológico (Cahill, 1990).
As bactérias probióticas quando inseridas também exercem interação com a composição dos microrganismos estruturais terrestres, da água e da espécie, resultando no aumento da capacidade das bactérias benéficas em contraste das patogênicas (Verschuere et al., 2000).
A microbiota gastrointestinal de espécies aquáticas é particularmente dependente do ambiente de cultivo, pois o fluxo de água faz parte da atividade de alguns órgãos e no caso do trato intestinal ocorre devido à ingestão constante de água no momento da alimentação.
As bactérias do ambiente, patogênicas ou não, também são ingeridas, podendo ser transitório o processo de desenvolvimento no intestino. Por esse motivo, recomenda-se a administração do probiótico desde os estágios larvais das espécies cultiváveis, contribuindo no decorrer dos estágios ontogenéticos (Kapareiko et al., 2011; Arıg et al., 2013).
As bactérias que fazem parte da microbiota dos peixes podem ser caracterizadas como:
![]() aeróbias
aeróbias
![]() anaeróbias facultativas
anaeróbias facultativas
![]() anaeróbias obrigatórias
anaeróbias obrigatórias
Atuando e contribuindo no desenvolvimento do seu hospedeiro via metabolismo, sistema imune e na resistência a doenças (Nayak, 2010; Araújo, 2015).
![]() ESTUDOS COM ESPÉCIES NATIVAS BRASILEIRAS
ESTUDOS COM ESPÉCIES NATIVAS BRASILEIRAS
O Tambaqui (Colossoma macropomum) é um peixe que vem contribuindo com o desenvolvimento da cadeia produtiva da piscicultura brasileira, tornando-se a espécie nativa mais produzida no país devido ao maior suporte tecnológico frente as diferentes técnicas de manejo e produção adotadas (IBGE, 2018). Apesar disso, estudos relacionados ao uso de probióticos para sua produção ainda são incipientes, bem como o entendimento de ação sobre a fisiologia da espécie.
No estudo realizado por Azevedo et al. (2016) avaliando o uso de diferentes aditivos, verificou-se melhorias nos parâmetros de crescimento e melhor uso de rações com probiótico B. subitilis e simbióticos na alimentação de juvenis de tambaqui.

O transporte dos peixes para produtores e a saúde dos animais está diretamente relacionado ao sistema imune, nesse sentido, Carvalho et al. (2009) constataram que o probiótico composto por B. subtilis, B. licheniformes, Lactobacilus acidophilis e Saccharomyces cerevisiae não foi eficiente em suprimir as respostas de estresse de juvenis de tambaqui durante o transporte, porém reduziu os parâmetros indicadores de estresse durante a fase de recuperação, ao contrário dos peixes transportados sem a adição do produto.
Entretanto, Ferreira et al. (2014) avaliando as características das vilosidades intestinais de tambaqui após o uso de Bacillus spp. via ração e dissolvido na água durante o transporte, identificou que os peixes não apresentaram influência sobre a morfofisiologia do sistema digestivo submetido ao procedimento de transporte.
O uso de B. subtilis e S. cerevisae como aditivo não influenciou no desempenho produtivo e composição corporal de tambaquis. No entanto, constatou-se que os peixes desafiados com S. agalactiae apresentaram variação benéfica dos parâmetros hematológicos para animais alimentados com aditivo probiótico contendo S. cerevisae (da Paixão et al., 2017).
A utilização de bactérias que compõem naturalmente o trato intestinal do hospedeiro, proporciona melhor eficiência e ação das bactérias quando produzido aditivo direcionado ao máximo de desempenho do animal. Em estudo conduzido por Kotzent (2017), avaliando a viabilidade de seis cepas de bactérias no intestino de juvenis de tambaqui saudáveis, foram identificadas quatro bactérias (S. hominis, L. lactis, P. pentosaceus e. hirae) com características favoráveis para serem utilizadas como probióticos sem causar danos ao hospedeiro.
![]()
O Pacu (Piaractus mesopotamicus) é considerado uma das espécies nativas da América do Sul com grande potencial para piscicultura brasileira. Entretanto, pesquisas relacionadas a viabilidade e uso de probióticos para sua produção estão em fase preliminar, visto que essa linha de aditivos nutricionais há pouco tempo despertou o interesse da pesquisa, bem como da iniciativa privada (Guidoli et al., 2018).
Guidoli et al. (2015) avaliaram um grupo de microrganismos probióticos aptos para a espécie seguindo uma ordem projetada, onde utilizaram espécimes matrizes de diferentes idades e sazonalidades, coletando como possíveis probióticos os microrganismos situados naturalmente na microbiota do pacu, objetivando determinar as espécies com melhor potencial. Foram caracterizadas as bactérias dos grupos Ácido lácteas e Bacillus que demonstraram melhores propriedades benéficas ao hospedeiro em avaliações in vitro.
 Estudos com a avaliação in vivo de cepas autóctones foram realizados, a partir da seleção e determinação da eficácia de oito microrganismos como probióticos para larvas de pacu, os quais demonstraram aumento no peso médios dos animais, bem como maior sobrevivência a partir a mistura (blend) dos microrganismos, representando atividade sinérgica dos grupos de bactérias avaliadas (Guidoli et al., 2018).
Estudos com a avaliação in vivo de cepas autóctones foram realizados, a partir da seleção e determinação da eficácia de oito microrganismos como probióticos para larvas de pacu, os quais demonstraram aumento no peso médios dos animais, bem como maior sobrevivência a partir a mistura (blend) dos microrganismos, representando atividade sinérgica dos grupos de bactérias avaliadas (Guidoli et al., 2018).
Tratando-se do sistema imune, a principal enfermidade do pacu produzido em cativeiro são infecções causadas por Aeromonas hydrophila. Nesta vertente, Farias et al., (2016), demonstram a capacidade de um probiótico contendo Bacillus cereus e Bacillus subtilis, 1:1, 108 CFU g−1 interferir positivamente nas respostas imunes do pacu diante de uma enfermidade tão importante para a espécie. Os resultados podem ser levados em consideração para manutenção da saúde de outras espécies de peixes.
Por fim, uma questão levantada quanto o uso de probióticos é a estabilidade e viabilidade dos microrganismos utilizados, principalmente quando inseridos nas dietas dos animais, uma das principais preocupações é o processo de extrusão.
Para a resolução desta problemática Rodrigues et al., (2014), desenvolveram uma técnica de microencapsulação protetiva do probiótico Lactobacillus acidophilus, desenvolvido para a alimentação de larvas de pacu. Apesar da eficiência da tecnologia, o desempenho dos animais não foi satisfatório na avaliação da dieta in vivo.
 O Jundiá (Rhamdia quelen) é uma espécie de bagre nativo da região Sul do país (Baldisserotto & Gomes, 2013), que adapta-se a variadas amplitudes térmicas, apresentando crescimento satisfatório mesmo em períodos frios. Nesse sentido, é considerada uma espécie promissora, apresentando ótimas características de crescimento e manejo no sistema de cultivo e boa aceitação no mercado consumidor, e por isso, produtores intensificaram seu cultivo em sistemas de criação intensiva (Diemer et al., 2012; Signor et al., 2013; Amaral Júnior et al., 2015; Rodrigues et al., 2017).
O Jundiá (Rhamdia quelen) é uma espécie de bagre nativo da região Sul do país (Baldisserotto & Gomes, 2013), que adapta-se a variadas amplitudes térmicas, apresentando crescimento satisfatório mesmo em períodos frios. Nesse sentido, é considerada uma espécie promissora, apresentando ótimas características de crescimento e manejo no sistema de cultivo e boa aceitação no mercado consumidor, e por isso, produtores intensificaram seu cultivo em sistemas de criação intensiva (Diemer et al., 2012; Signor et al., 2013; Amaral Júnior et al., 2015; Rodrigues et al., 2017).
Contudo, os estudos utilizando probióticos para a espécie ainda são insuficientes, e trabalhos recentes foram conduzidos especialmente na fase de larvicultura, apresentando melhor desempenho zootécnico e maior uniformidade das larvas de jundiás aos 21 dias de vida (Pinto et al. 2015).
Souza et al., (2012) avaliaram a viabilidade de B. cereus var. toyoi e Saccharomyces boulardii na água de cultivo de larvas de jundiá, ambos os probióticos têm um efeito inibitório in vitro contra Vibrio carchariaee que proliferam na água, entretanto, nenhum efeito foi observado nos parâmetros de crescimento. Mas a inclusão dietética de probiótico contendo Lactococcus lactis na fase larval de jundiá interfere positivamente a sobrevivência e reduz no crescimento de vibrios intestinais nos peixes (Spanghero, 2017).
Estudos de probióticos concentrados com maior número de UFC (unidade formadora de colônias) compostos por B. careus e B. subtilis em dietas para R. quelen proporcionaram:
![]() melhora no crescimento
melhora no crescimento
![]() desempenho produtivo
desempenho produtivo
![]() manutenção da integridade e mecanismos celulares ao estresse oxidativo hepático de peixes (Rodrigues et al., 2020)
manutenção da integridade e mecanismos celulares ao estresse oxidativo hepático de peixes (Rodrigues et al., 2020)
Além de aumentar o desempenho reprodutivo de machos e fêmeas, como o número de fêmeas desovando e a taxa de fertilização, o desenvolvimento de células germinativas e a qualidade dos espermatozoides (Lins Rodrigues et al., 2020).
![]() A adição de probiótico na alevinagem de outras espécies nativas como o robalo (Centropomus undecimalis), em que as bactérias B. subtilis foram incluídas na dieta, influenciaram os peixes agindo como imunoestimulante, proporcionando o aumento da explosão respiratória, hemácias e contagem de leucócitos, quando os peixes passaram por um período de privação alimentar, alternando a oferta de alimento (Noffs et al., 2015).
A adição de probiótico na alevinagem de outras espécies nativas como o robalo (Centropomus undecimalis), em que as bactérias B. subtilis foram incluídas na dieta, influenciaram os peixes agindo como imunoestimulante, proporcionando o aumento da explosão respiratória, hemácias e contagem de leucócitos, quando os peixes passaram por um período de privação alimentar, alternando a oferta de alimento (Noffs et al., 2015).
| Atualmente a literatura relacionada ao uso de probióticos na alimentação e saúde de espécies nativas é restrita. Entretanto, é incessante a busca por aditivos eficazes para uma aquicultura mais sustentável, aliado ao crescimento da piscicultura de espécies nativas do Brasil. Deste modo, é possível que estudos a partir de diferentes espécies promovam maior visibilidade e confiança no uso de aditivos probióticos na piscicultura. |
CONSIDERAÇÕES SOBRE O USO DE PROBIÓTICO
![]() A escolha das bactérias probióticas deve levar em consideração a microbiota do hospedeiro ou microrganismos generalistas, que estão em todo ambiente, não ter potencial toxicogênico e beneficiar o hospedeiro.
A escolha das bactérias probióticas deve levar em consideração a microbiota do hospedeiro ou microrganismos generalistas, que estão em todo ambiente, não ter potencial toxicogênico e beneficiar o hospedeiro.
![]() A utilização de aditivos probióticos apesar de aumentar o custo de produção, reflete em múltiplos efeitos aos animais e ao ambiente, contribui para a sustentabilidade do sistema de produção.
A utilização de aditivos probióticos apesar de aumentar o custo de produção, reflete em múltiplos efeitos aos animais e ao ambiente, contribui para a sustentabilidade do sistema de produção.
![]() A dosagem inadequada e uso esporádico do aditivo probiótico podem ser insuficientes para melhorar a imunidade, fisiologia, crescimento e resistência a doenças nos peixes. Além disso, o uso contínuo do aditivo garante a estabilidade e manutenção da microflora no hospedeiro.
A dosagem inadequada e uso esporádico do aditivo probiótico podem ser insuficientes para melhorar a imunidade, fisiologia, crescimento e resistência a doenças nos peixes. Além disso, o uso contínuo do aditivo garante a estabilidade e manutenção da microflora no hospedeiro.
![]() A conservação da ração com aditivo e fatores como a temperatura e o tempo de armazenamento influenciam no desempenho das bactérias e sua viabilidade.
A conservação da ração com aditivo e fatores como a temperatura e o tempo de armazenamento influenciam no desempenho das bactérias e sua viabilidade.
Autora: Mariana Lins Rodrigues1
1Doutora em Recursos Pesqueiros e Engenharia de Pesca
Universidade Estadual do Oeste do Paraná
 Clique e leia também!
Clique e leia também!
Aspectos de qualidade determinantes para a escolha de rações para peixes
Amaral Junior H, Garcia S, Warmling PF, Silva BC, Marchiori NC (2015). Assim cultivamos o Jundiá Rhamdia quelen no estado de Santa Catarina (1ª ed). EPAGRI/CNPQ/MPA/FAPESC.78p.
Araújo C, Muñoz-Atienza E, Nahuelquín Y, Poeta P, Igrejas G, Hernández PE, Cintas L M (2015). Inhibition of fish pathogens by the microbiota from rainbow trout (Oncorhynchus mykiss, Walbaum) and rearing environment. Anaerobe 32: 7–14.
Arig N, Suzer C, Gokvardar A, Basaran F, Coban D, Yildirim S, Saka S. (2013). Effects of probiotic (Bacillus sp.) supplementation during larval development of Gilthead Sea Bream (Sparus aurata, L.). Turkish Journal of Fisheries & Aquatic Sciences 13: 407–414.
Azevedo RV, Filho JCF, Pereira SL, Cardoso LD, Júnior MVV, Andrade DR (2016). Suplementação com prebiótico, probiótico e simbiótico para juvenis de tambaqui a duas densidades de estocagem. Pesquisa Agropecuária Brasileira 51: 9-16.
Balcazar JL, De Blas I, Ruiz-Zarzuela I, Vendrell D, Calvo AC, Marquez I, Girones O, Muzquiz JL. (2007). Changes in intestinal microbiota and humoral immune response following probiotic administration in brown trout (Salmo trutta). British Journal of Nutrition 97: 522-527.
Baldisserotto B, Gomes LC (2013). Espécies nativas para a piscicultura no Brasil. 2. ed. Santa Maria: UFSM, 608p.
BRASIL, Decreto 76.986 de 06 de janeiro de 1976. Dispõe sobre a inspeção e a fiscalização obrigatórias dos produtos destinados a alimentação animal e dá outras providências.
BRASIL, Instrução Normativa 15/2009. Ministério da Agricultura, Pecuária e Abastecimento.
Cahill MM (1990). Virulence factor in motile Aeromonas: a review. Journal of Applied Microbiology 16: 1-16.
Carvalho ES, Gomes LC, Brandão FR, Crescêncio R, Chagas EC, Anselmo AAS (2009). Uso do probiótico Efinol®L durante o transporte de tambaqui (Colossoma macropomum). Arquivo Brasileiro Medicina Veterinária e Zootecnia 61: 1322-1327.
Cavalheiro, ACM, Castro, MLS, Einhardt, MDS., Pouey, JLOF, Piedras, SN, Xavier, EG (2014). Microingredientes utilizados em alimentação de peixes em cativeiro – Revisão. Revista Portuguesa de Ciências Veterinárias 109: 11-20.
COMPANHIA ENERGÉTICA DE SÃO PAULO. (2006). 40 peixes do Brasil: CESP 40 anos. José Caldas (fotografia); João Henrique Pinheiro Dias, Oscar Akio Shibatta (pesquisa e texto); Oscar Akio Shibatta (ilustrações). Rio de Janeiro: Doiis.
Da Paixão AEM, dos Santos JC, Pinto MS, Pereira DSP, de Oliveira Ramos CEC et al (2017). Effect of commercial probiotics (Bacillus subtilis and Saccharomyces cerevisiae) on growth performance, body composition, hematology parameters, and disease resistance against Streptococcus agalactiae in tambaqui (Colossoma macropomum). Aquaculture International 25(6): 2035–2045.
Dawood MA, Koshio S, Ishikawa M, Yokoyama S, El Basuini MF, Hossain MS, Nhu TH, Dossou S, Moss AS (2016). Effects of dietary supplementation of Lactobacillus rhamnosus or/and Lactococcus lactis on the growth, gut microbiota and immune responses of red sea bream, Pagrus major. Fish & Shellfish Immunology 49: 275-285.
Dawood MAO, Koshio S, Abdel-Daim MM, Van-Doan H (2018). Probiotic application for sustainable aquaculture. Reviews in Aquaculture 1-18.
Dawood MAO, Koshio SH, Ishikawa M, Yokoyama S (2015). Effects of heat killed Lactobacillus plantarum (LP20) supplemental diets on growth performance, stress resistance and imune response of red sea bream, Pagrus major. Aquaculture 442: 29–36.
Diemer O, Neu DH, Sary C, Finkler JK, Boscolo WR, Feiden A (2012). Artemia sp. Na alimentação de larvas de jundiá (Rhamdia quelen). Ciência Animal Brasileira 13: 175–179.
Farias THV, Levy-Pereira N, Oliveira Alves L, Carla Dias D, Tachibana L et al. (2016). Probiotic feeding improves the immunity of pacus, Piaractus mesopotamicus, during Aeromonas hydrophila infection. Animal Feed Science and Technology 211: 137-144.
Ferreira CM, Antoniassi NAB, Silva FG, Povh JA, Potença A et al. (2014). Características histomorfométricas do intestino de juvenis de tambaqui após uso de probiótico na dieta e durante transporte. Pesquisa Veterinária Brasileira, 34: 1258–1264.
Guidoli MG, Mendoza JA, Falcón SL, Boehringer SI, Sánchez S et al. (2018). Autochthonous probiotic mixture improves biometrical parameters of larvae of Piaractus mesopotamicus (Caracidae, Characiforme, Teleostei). Ciência Rural 48: (p.1-7).
Guidoli MG, Santinón JJ, Pasteri SE, Sánchez S, Nader-Macías MEF (2015). Isolation and selection of potentially beneficial autochthonous bacteria for Piaractus mesopotamicus aquaculture activities. Bioprocessing & Biotechniques 5: 1-10.
IBGE (2019). Instituto Brasileiro de Geografia e Estatística. Pesquisa da Pecuária Municipal. Rio de Janeiro, Brasil IBGE, 47: 1-8.
Ibrahem MD (2015). Evolution of probiotics in aquatic world: Potential effects, the current status in Egypt and recent prospectives. Journal of Advanced Research 6: 765–791.
Kapareiko D, Lim HJ, Schott EJ, Hanih A, Wikfors GH (2011). Isolation and Evaluation of New Probiotic Bacteria for use in Shellfish Hatcheries: II. Effects of a Vibrio sp. Pro biotic candidate upon survival of oyster larvae (Crassostrea virginicai) in pilot-scale trials. Journal Shellfish Research 30: 617-625.
Kiron, V. (2015). Gastrointestinal Microorganisms of Fish and Probiotics. Dietary Nutrients, Additives, and Fish Health 14: 283–303.
Kotzent S (2017). Bactérias com potencial probiótico do intestino de tambaqui (Colossoma macropomum). Dissertação (Mestrado em Microbiologia Agropecuária) – Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, São Paulo, pp.48.
Lins-Rodigues M, Damasceno DZ, Gomes RLM, et al. (2020). Probiotic effects (Bacillus cereus and Bacillus subtilis) on growth and physiological parameters of silver catfish (Rhamdia quelen). Aquaculture Nutrition 00: 1–14.
Nath A, Molnár MA, Csighy A, Kőszegi K, Galambos I et al. (2018). Biological Activities of Lactose-Based Prebiotics and Symbiosis with Probiotics on Controlling Osteoporosis, Blood-Lipid and Glucose Levels. Medicina 54: 2-28.
Noffs, A P, Tachibana, L., Santos, A A., Ranzani‑Paiva, M J T (2015). Common snook fed in alternate and continuous regimens with diet supplemented with Bacillus subtilis probiotic. Pesquisa Agropecuária Brasileira 50(4): 267-272.
Paixão, L.A. and Castro, F.F.S. (2016). A colonização da microbiota intestinal e sua influência na saúde do hospedeiro*. Universitas: Ciências da Saúde, 14(1), 85-96.
Pinto VB, Costenaro-Ferreira C, Oliveira PLS, Oliveira RRB de, Piedras SRN et al. (2015). Performance of jundiá larvae, Rhamdia quelen, fed on probiotic supplemented diets. Acta Scientiarum. Animal Sciences 37(3): 215-220.
Rodrigues JB, Leitão NJ, Chaves KS, Gigante ML, Portella MC et al. (2014). High protein microparticles produced by ionic gelation containing Lactobacillus acidophilus for feeding pacu larvae. Food Research International 63: 25-32.
Rodrigues ML, Snchez MS, Damasceno DZ, Bittencourt F, Reidel A et al. (2017). Reproductive performance of silver catfish fed sorghum diets supplemented with phytase. Pesquisa Agropecuária Brasileira 52: 623-632.
Rodrigues, ML, Damasceno, DZ, Gomes, RLM,Sosa, BS, Moro, EB, Sanches, EA, Bittencourt, F, Signor, A (2021). Reproductive physiology of Rhamdia quelen is improved by dietary inclusion of probiotics. Aquaculture research 52(4): 1677-1687
Signor A, Feiden A, Boscolo WR, Signor AA, Gonçalves GS et al. (2013). Eventos reprodutivos do jundiá Rhamdia voulezi cultivados em tanques-rede. Revista Brasileira de Reprodução Animal 37: 272-277.
Silva, F.C.P.; Brito, M.F.G.; Farias, L.M. (2005). Composition and antagonistic activity of the indigenous intestinal microbiota of Prochilodus argenteus Agassiz. J. Fish Biol., 67, 1686-1698.
Souza DM, Martins GB, Piedras SRN, Pouey JLOF, Robaldo RB et al. (2012). Probiotic actions of Bacillus cereus var. toyoi and Saccharomyces boulardii in silver catfish (Rhamdia quelen) larvae culture. Revista Brasileira de Zootecnia 41(3): 815-819
Spanghero ECAM (2017). Utilização do probiótico Lactococcus lactis na larvicultura do jundiá Rhamdia quelen. (Dissertação de Mestrado, Universidade Federal de Santa Catarina) Centro de Ciências Agrárias, 56p.
Verschuere, L., Roumbaut, G., Sorgeloos, P., Verstraete, W. (2000). Probiotic Bacteria as Biological Control Agents in Aquaculture. Microbiology and Molecular Biology Reviews, 64 (4): 655-671.
[/registrados]
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar esta publicação e muito mais conteúdo especializado. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em nutriNews
REGISTRE-SE











