Tras el destete una de las principales inquietudes de los productores porcinos es cómo conservar y proteger la salud intestinal de los lechones. Sin embargo, el concepto de salud intestinal es mucho más complejo de lo que parece, pues abarca una serie de características fisiológicas y funcionales que determinarán la digestión y absorción de nutrientes, el metabolismo y generación de energía y las respuestas inmunitarias de las mucosas (Pluske et al., 2018).
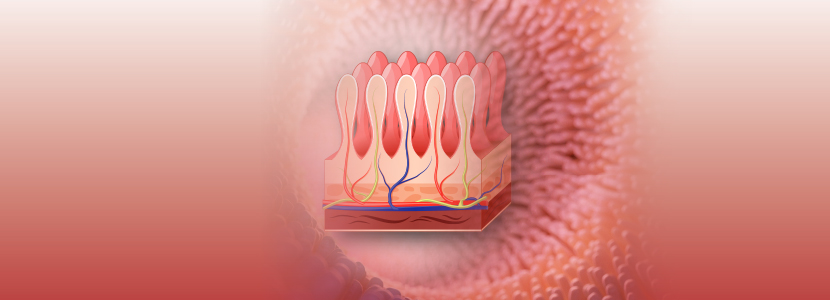
La integridad intestinal puede ser definida como el mantenimiento de la estructura física (enterocitos, vascularización, mucus) y funcional del intestino (absorción, respuesta inmune, impermeabilidad) (Bischoff, 2011) (Figura 1).
Figura 1. Diferentes componentes de la barrera intestinal del TGI. Los elementos estructurales incluyen (1) capa mucosa, (2) epitelio intestinal y (3) microbiota comensal. Los elementos inmunológicos consisten en (4) péptidos antimicrobianos (AMPs) secretados por células de Paneth y enterocitos, (5) inmunidad celular. Extraído de Farré et al., (2020)
De hecho, durante el destete y especialmente en destetes tempranos (21 días de edad o menos), los lechones no sólo sufren un cambio social y nutricional repentino, sino también un cambio intestinal en estructura y función, conocidos en conjunto como el síndrome post destete.
En efecto, el cambio en la dieta ha sido asociado con una ingesta baja de alimento y agua resultando en un periodo de anorexia de entre 24 a 48 horas (Lallès et al., 2007), lo que a su vez producirá, según diversos autores:
→ Alteraciones morfológicas intestinales sustanciales como la atrofia de las vellosidades (Wiese et al., 2003)
→ Inflamación local en el intestino delgado (Pié et al., 2004)
→ Disminución de actividad enzimática (Montagne et al., 2007)
→ Respuesta inmune reducida y microbiota intestinal alterada (McLamb et al., 2013).
→ Y precisamente es esta alteración microbiana intestinal la principal causante de diarreas post destete (Modina et al., 2019). La presencia de diarreas complicará aún más el cuadro clínico con la fermentación de los nutrientes, que no alcanzan a ser digeridos, estimulando así el crecimiento de baterías patógenas principalmente en la región ileal (Lallès et al., 2007).
En este sentido la dieta es un regulador sustancial de la integridad intestinal, así como también el estado de integridad del intestino condicionará la digestión y absorción de nutrientes.
De hecho, de entre todos los nutrientes que más influyen tanto en la integridad de la pared intestinal como en la proliferación microbiana en el intestino destacan las proteínas y los carbohidratos, especialmente la fracción de fibra soluble e insoluble.
En los siguientes apartados describiremos brevemente las interacciones entre la dieta y la integridad intestinal:
Manejo y digestión de la Proteína
Como ya hemos mencionado anteriormente, al destete el intestino no ha madurado por completo, hay un descenso en la actividad digestiva enzimática y como consecuencia el alimento no digerido será fermentado por las bacterias entéricas.
Tanto el tipo de proteína como el nivel suministrado en la dieta pueden contribuir, como nos indican Pluske et al., 2002, al:
- Deterioro intestinal.
- Crecimiento selectivo de bacterias proteolíticas (p.ej. Clostridios y Escherichia) en lugar de sacarolíticas.
- Detrimento en la digestión de nutrientes y por lo tanto en la mayor incidencia de diarreas .
» Un efecto importante de la fermentación de proteína no digerida es el aumento en la concentración de productos tóxicos como el amoniaco y la amina, lo que, a su vez además de afectar negativamente a la integridad intestinal (Jha & Berrocoso, 2016) también puede afectar a los procesos de digestión y absorción en el intestino de otros nutrientes.
En general, se recomienda reducir el contenido de proteína bruta tanto como sea posible, pero sin que esto afecte la salud y el rendimiento productivo, por el déficit de aminoácidos esenciales, ni los costos de formulación.
» Para ello será fundamental formular con aminoácidos esenciales sintéticos, cumpliendo con el perfil de proteína ideal, al igual que usar fuentes de proteína altamente digestible, como las materias primas de origen animal cuando sea pertinente (Heo et al., 2013; Pérez-Bosque et al., 2016).
| En lechones post destete, se ha sugerido que la fermentación de proteínas predispone a la colonización e infección de bacterias patógenas como Escherichia coli (Heo et al., 2009). |
⇒ Efecto de suministrar dos niveles de proteína
Es así que Wu et al., (2015) se propusieron estudiar el efecto de suministrar dos niveles de proteína, mediante dos tipos de fuente proteica, frente a una dieta control:
- Dieta control, formulada con harina de soja (17%)
- Dieta con concentrado de proteína de soja, CPS(19%) y CPS (23%)
- Dieta con harina de pescado, HP (19%) y HP (23%)
Estos investigadores observaron que el nivel bajo de proteína (17%) produjo efectos positivos, en comparación con los niveles más elevados (19 vs 23%), en:
- El rendimiento productivo
- La morfología intestinal
- La expresión de genes de función barrera (IL-1β, IFN-γ, ZO-1, OCLN)
La altura de las vellosidades del yeyuno de los lechones en el grupo de control (17% PB) fueron significativamente más altas que las de los alimentados con las dietas CPS19, CPS23 y HP23 (P <0.05).
En tanto que se observó una mayor profundidad de cripta en aquellos lechones alimentados con las dietas CPS23 y HP23 en comparación con los alimentados con la dieta control (17% PB) y HP19 (P <0.05), como se puede observar en la figura 2A.
Figura 2. Efecto de niveles (17, 19, 23%) y fuentes de proteína (harina de soja, concentrado proteico de soja, y harina de pescado) sobre la morfología intestinal (A) y abundancia ARNm (B) del yeyuno en lechones destetados. Extraído de Wu et al., (2015)
Generalmente, los índices morfométricos del intestino delgado, como la altura de las vellosidades, la profundidad de las criptas y la relación de ambas, son buenos indicadores del estado de integridad intestinal (Han et al., 2013).
Un aumento en la altura de las vellosidades implica un aumento en el área de absorción intestinal (Caspary, 1992), mientras que una mayor profundidad de criptas indica un recambio epitelial de las vellosidades más rápido en respuesta a la descamación normal o la inflamación patógena (Yason et al., 1987).
Por lo tanto y en base a estos resultados podemos decir que la alimentación de lechones con niveles superiores a 17% de proteína puede inducir el deterioro de la integridad y función intestinal, asociado con un estímulo en respuestas inflamatorias intestinales (ver los niveles de IL-1β e IFN-ϒ en la Figura 2B).
Manejo y digestión de la Fibra
La fibra es un nutriente versátil que según su uso puede promover o perjudicar la integridad del intestino.
Generalmente, la fibra no es completamente digerida por lo que, al avanzar hacia el intestino posterior promoverá la llegada de sustratos disponibles en mayor o menor medida para su fermentación por las bacterias del intestino grueso.
De acuerdo con las propiedades fisicoquímicas, capacidad de fermentación y efectos fisiológicos en el intestino, la fibra clásicamente se ha categorizado como fibra soluble e insoluble.
Fibra soluble
La fibra soluble (p.ej. trigo, cebada, pulpa de remolacha) se caracteriza por incrementar la viscosidad de la digesta debido a su notable capacidad para disolverse en agua.
⇒ El efecto de la viscosidad es más pronunciado en las aves.
Fibra insoluble
La fibra insoluble (p.ej. salvado de trigo, maíz, sorgo) funciona primariamente como fibra mecánica aumentado la velocidad de tránsito, lo que a su vez estimula el desarrollo del TGI y por lo tanto la digestibilidad de otros nutrientes.
Además, al aumentar la velocidad de tránsito se estima que la mayor parte de la fermentación ocurrirá en el intestino grueso y ciego antes que en el intestino delgado, reduciendo la incidencia de diarreas (Chen et al., 2020).
En general, los dos tipos de fibra pueden modificar la absorción de otros nutrientes, así como la estructura y mantenimiento del intestino.
| No obstante, dietas pobres en fibra han mostrado afectar negativamente a la función barrera mientras se incrementa la susceptibilidad a patógenos en el intestino (Desai et al., 2016).
Por lo tanto, será ineludible incluir un mínimo de ambos tipos de fibra (soluble e insoluble) para mantener la fisiología e integridad del intestino. |
Estudio sobre el efecto de suministrar distintos niveles de fibra soluble e insoluble
OBJETIVO
En este sentido podemos destacar los resultados de un estudio reciente realizado por Chen y colaboradores (2020) en el que se estudió los efectos de la suplementación de fibra en lechones destetados.
MATERIAL & MÉTODOS
Durante las dos primeras semanas se establecieron los siguientes tratamientos de fibra soluble e insoluble:
- soluble (1% soluble + 0% insoluble)
- insoluble (0% soluble + 1% insoluble)
- mezcla (0.5% soluble + 0.5% insoluble)
- mezcla (0.25 % soluble + 0.75% insoluble) por las dos primeras semanas seguido de la mezcla (0.75 % soluble + 0.25 % insoluble) por las dos siguientes semanas
RESULTADOS
» Los resultados mostraron un mejor rendimiento productivo (G/F) en los lechones alimentados con la mezcla de fibra soluble e insoluble (0.5/0.5 y 0.25/0.75) y en aquellos que recibieron la dieta solo con fibra insoluble (P < 0.05) durante las dos primeras semanas.
» Al evaluar los efectos de estas dietas en parámetros séricos como la proteína total y albúmina y en la expresión de genes de función barrera (OCLN, CLDN-1, MUC1, IL-10) en el íleon, los dos tipos de combinación con fibra soluble e insoluble mostraron mejores concentraciones de ambos parámetros en comparación con las otras dietas.
» Además, tanto las dos combinaciones de fibra como la dieta con únicamente fibra insoluble produjeron concentraciones más elevadas de ácidos grasos de cadena corta en la digesta cecal (P < 0.05) en comparación con la dieta control.
» El rendimiento productivo superior, sumado a las mejoras en parámetros bioquímicos y génicos, son indicadores que suministrar dietas con una mezcla de fibra soluble e insoluble podrían funcionar de manera sinérgica al potenciar los efectos individuales de cada tipo de fibra (Liu et al., 2012).
De hecho, una recomendación práctica podría ser la suplementación de niveles moderados de fibra, preferiblemente con un tamaño de partícula grueso, para ayudar en la maduración del TGI, así como al desarrollo de la microbiota intestinal saprófita y a la reducción en la adhesión de bacterias patógenas a la mucosa intestinal, especialmente cuando los animales presentan un estado de salud comprometido (Molist et al., 2014).
CONCLUSIÓN
Mantener la integridad de la barrera intestinal de los lechones, especialmente en etapas críticas como el destete, no es solo fundamental para atenuar todas las consecuencias del síndrome post destete sino para procurar el máximo rendimiento productivo y económico de los futuros cerdos de engorde.
La integridad intestinal puede verse afectada por varios factores, principalmente los componentes dietéticos, como la fibra y proteína, cuya digestión a su vez se verá afectada por el estado de salud del intestino.
Referencias
Bischoff, S. C. (2011). “Gut health”: A new objective in medicine? BMC Medicine, 9. https://doi.org/10.1186/1741-7015-9-24
Caspary, W. F. (1992). Physiology and pathophysiology of intestinal absorption. The American Journal of Clinical Nutrition, 55(1). https://doi.org/10.1093/ajcn/55.1.299s
Chen, T., Chen, D., Tian, G., Zheng, P., Mao, X., Yu, J., He, J., Huang, Z., Luo, Y., Luo, J., & Yu, B. (2020). Effects of soluble and insoluble dietary fiber supplementation on growth performance, nutrient digestibility, intestinal microbe and barrier function in weaning piglet. Animal Feed Science and Technology, 260. https://doi.org/10.1016/j.anifeedsci.2019.114335
Desai, M. S., Seekatz, A. M., Koropatkin, N. M., Kamada, N., Hickey, C. A., Wolter, M., Pudlo, N. A., Kitamoto, S., Terrapon, N., Muller, A., Young, V. B., Henrissat, B., Wilmes, P., Stappenbeck, T. S., Núñez, G., & Martens, E. C. (2016). A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell, 167(5). https://doi.org/10.1016/j.cell.2016.10.043
Farré, R., Fiorani, M., Rahiman, S. A., & Matteoli, G. (2020). Intestinal permeability, inflammation and the role of nutrients. In Nutrients (Vol. 12, Issue 4). MDPI AG. https://doi.org/10.3390/nu12041185
Han, F., Hu, L., Xuan, Y., Ding, X., Luo, Y., Bai, S., He, S., Zhang, K., & Che, L. (2013). Effects of high nutrient intake on the growth performance, intestinal morphology and immune function of neonatal intra-uterine growth-retarded pigs. British Journal of Nutrition, 110(10). https://doi.org/10.1017/S0007114513001232
Heo, J. M., Kim, J. C., Hansen, C. F., Mullan, B. P., Hampson, D. J., & Pluske, J. R. (2009). Feeding a diet with decreased protein content reduces indices of protein fermentation and the incidence of postweaning diarrhea in weaned pigs challenged with an enterotoxigenic strain of Escherichia coli1. Journal of Animal Science, 87(9). https://doi.org/10.2527/jas.2008-1274
Heo, J. M., Opapeju, F. O., Pluske, J. R., Kim, J. C., Hampson, D. J., & Nyachoti, C. M. (2013). Gastrointestinal health and function in weaned pigs: a review of feeding strategies to control post-weaning diarrhoea without using in-feed antimicrobial compounds. Journal of Animal Physiology and Animal Nutrition, 97(2). https://doi.org/10.1111/j.1439-0396.2012.01284.x
Jha, R., & Berrocoso, J. F. D. (2016). Dietary fiber and protein fermentation in the intestine of swine and their interactive effects on gut health and on the environment: A review. Animal Feed Science and Technology, 212. https://doi.org/10.1016/j.anifeedsci.2015.12.002
Lallès, J.-P., Bosi, P., Smidt, H., & Stokes, C. R. (2007). Weaning — A challenge to gut physiologists. Livestock Science, 108(1–3). https://doi.org/10.1016/j.livsci.2007.01.091
McLamb, B. L., Gibson, A. J., Overman, E. L., Stahl, C., & Moeser, A. J. (2013). Early Weaning Stress in Pigs Impairs Innate Mucosal Immune Responses to Enterotoxigenic E. coli Challenge and Exacerbates Intestinal Injury and Clinical Disease. PLoS ONE, 8(4). https://doi.org/10.1371/journal.pone.0059838
Modina, S. C., Polito, U., Rossi, R., Corino, C., & di Giancamillo, A. (2019). Nutritional Regulation of Gut Barrier Integrity in Weaning Piglets. Animals, 9(12). https://doi.org/10.3390/ani9121045
Molist, F., van Oostrum, M., Pérez, J. F., Mateos, G. G., Nyachoti, C. M., & van der Aar, P. J. (2014). Relevance of functional properties of dietary fibre in diets for weanling pigs. In Animal Feed Science and Technology (Vol. 189, pp. 1–10). https://doi.org/10.1016/j.anifeedsci.2013.12.013
Montagne, L., Boudry, G., Favier, C., Huërou-Luron, I. le, Lallès, J.-P., & Sève, B. (2007). Main intestinal markers associated with the changes in gut architecture and function in piglets after weaning. British Journal of Nutrition, 97(1). https://doi.org/10.1017/S000711450720580X
Pérez-Bosque, A., Polo, J., & Torrallardona, D. (2016). Spray dried plasma as an alternative to antibiotics in piglet feeds, mode of action and biosafety. Porcine Health Management, 2(1). https://doi.org/10.1186/s40813-016-0034-1
Pié, S., Lallès, J. P., Blazy, F., Laffitte, J., Sève, B., & Oswald, I. P. (2004). Weaning Is Associated with an Upregulation of Expression of Inflammatory Cytokines in the Intestine of Piglets. The Journal of Nutrition, 134(3). https://doi.org/10.1093/jn/134.3.641
Pluske, J. R., Pethick, D. W., Hopwood, D. E., & Hampson, D. J. (2002). Nutritional influences on some major enteric bacterial diseases of pig. Nutrition Research Reviews, 15(2). https://doi.org/10.1079/NRR200242
Pluske, J. R., Turpin, D. L., & Kim, J. C. (2018). Gastrointestinal tract (gut) health in the young pig. In Animal Nutrition (Vol. 4, Issue 2, pp. 187–196). KeAi Communications Co. https://doi.org/10.1016/j.aninu.2017.12.004
Wiese, F., Simon, O., & Weyrauch, K. D. (2003). Morphology of the Small Intestine of Weaned Piglets and a Novel Method for Morphometric Evaluation+. Anatomia, Histologia, Embryologia: Journal of Veterinary Medicine Series C, 32(2). https://doi.org/10.1046/j.1439-0264.2003.00430.x
Wu, Y., Jiang, Z., Zheng, C., Wang, L., Zhu, C., Yang, X., Wen, X., & Ma, X. (2015). Effects of protein sources and levels in antibiotic-free diets on diarrhea, intestinal morphology, and expression of tight junctions in weaned piglets. Animal Nutrition, 1(3), 170–176. https://doi.org/10.1016/j.aninu.2015.08.013
Yason, C.V., Summers, B. A., Schat, K. A. (1987). Pathogenesis of rotavirus infection in various age groups of chickens and turkeys :pathology. American Journal of Veterinary Research 48(6), 927–38.