Desde hace algunos años, el estudio de proteínas y péptidos bioactivos o funcionales, así como el desarrollo de la aplicación de los mismos en nutrición porcina, están experimentando un creciente interés, tanto en organismos públicos de investigación como en empresas privadas dada la importante repercusión que el uso de este tipo de productos puede llegar a tener sobre el bienestar, la salud y el rendimiento productivo de los animales.
Las proteínas y los péptidos bioactivos son moléculas que, además de su valor nutricional como fuente de aminoácidos, son capaces de ejercer actividades biológicas específicas.
LAS PROTEÍNASY LOS PÉPTIDOS BIOACTIVOS OPTIMIZAN LAS FUNCIONES VITALES DEL ORGANiSMO ANIMAL Y REDUCEN EL RIESGO DE ENFERMEDAD
Además, muchos de estos péptidos y proteínas bioactivos presentan una marcada actividad antimicrobiana. De hecho, las proteínas y péptidos antimicrobianos representan un antiguo sistema de defensa en un gran número de animales y plantas, poniéndoles su alta efectividad en primera línea de defensa.
Las fuentes de proteína alimentaria habitualmente utilizadas en la fabricación de piensos compuestos son inicialmente susceptibles de aportar proteínas y péptidos funcionales a los cerdos.
Muchos péptidos bioactivos pueden ser originados in vivo por la digestión de la proteína de la dieta.
Para la producción a escala industrial de este tipo de sustancias activas se están extrayendo proteínas y aislando péptidos bioactivos mediante hidrólisis enzimática a partir de materias primas como leche, huevos, patatas, colágeno etc.
Además de estos péptidos naturales, en la actualidad se están obteniendo otros péptidos de tipo semisintético, gracias a la modificación parcial de la estructura molecular de péptidos naturales a fin de mejorar sustancialmente sus actividades biológicas, o incluso ya se están sintetizando péptidos bioactivos inexistentes como tales en la naturaleza.
En el presente artículo se revisan algunos de los trabajos científicos sobre las principales proteínas y péptidos funcionales, y en particular sobre su inclusión en dietas para ganado porcino, trabajos en los cuales se evidencia como estas sustancias pueden ejercer su acción tanto a nivel local (tracto gastrointestinal) como sistémico, ya que en ocasiones pueden atravesar el epitelio intestinal y alcanzar tejidos periféricos a través de la circulación sanguínea.
En esta primera parte, vamos a realizar una revisión bibliográfica sobre las proteínas y péptidos derivados de la leche y plasma porcino. Y en la segunda parte, trataremos los derivados de huevos y otros (vegetales, sintéticos,..)
Proteínas y péptidos derivados de la leche
Son diversas las proteínas y péptidos bioactivos derivados de la leche cuyo uso ya está, en mayor o menor medida, introducido en la fabricación de piensos para porcino. Algunos de estos productos vienen utilizándose como ingredientes desde hace muchos años, mientras que otros son actualmente motivo de nuevas investigaciones y su aplicación en nutrición animal está todavía en las fases iniciales.
Es bien sabido que los concentrados de proteína de lactosuero son un ingrediente de alto valor nutritivo en dietas para lechones, a pesar de su escasa disponibilidad por destinarse preferente- mente a la alimentación humana.
LA PROTEINA DE LACTOSUERO, ADEMÁS DE SU ALTO VALOR NUTRITIVO, PRESENTA UNA NOTABLE ACTIVIDAD ANTIOXIDANTE E INMUNOMODULADORA

Figura 1. La cisteína, contribuye a la síntesis de glutatión necesaria para la proliferación y actividad de células del sistema inmune, concretamente de linfocitos y, particularmente, de las células T.
Ambas actividades, antioxidante e inmunomo- duladora, se relacionan con su alto contenido en cisteína, contribuyendo a la síntesis de glutatión, potente antioxidante intracelular. éste es, a su vez, necesario para la proliferación y actividad de células del sistema inmune, concretamente de linfocitos y, particularmente, de las células T (Marshal, 2004).
El efecto positivo de la inclusión de proteína de lactosuero en dietas para lechones sobre la digestibilidad de los nutrientes o sobre el rendimiento productivo ha sido demostrado desde hace años en numerosas pruebas de campo, además de en diversos estudios científicos (Tokach y col., 1989; Grinstead y col, 2000; Gottlob y col., 2006; Naranjo y col., 2010; Kobayashi y col. 2011).
→ Glicomacropéptido
Entre los principales péptidos presentes en la proteína del lactosuero merece una consideración especial el glicomacropéptido (GMP), un péptido bioactivo derivado de la digestión de la K–caseína.
La secuencia de aminoácidos del GMP, la cual no contiene aminoácidos aromáticos ni algunos otros aminoácidos esenciales (Brody, 2000), confiere al GMP una estructura difícilmente abordable por las proteasas endógenas como la tripsina, quimiotripsina y pepsina, las cuales tienen más afinidad por los enlaces entre este tipo de aminoácidos (Erickson y Kim, 1990).
El glicomacropéptido (GMP) favorece el mantenimiento de la morfología y función de la mucosa intestinal.
Diversos autores (Brody, 2000; Daddaoua y col., 2005; Rhoades y col., 2005; López-Posadas y col., 2010) han estudiado las actividades biológicas del GMP in vitro o en animales de experimentación, indicando que éste es capaz de unirse a toxinas de Escherichia coli enterotóxica (ETEC), inhibir la adhesión bacteriana y viral a las células intestinales, promover el crecimiento de bifidobacterias en el intestino, modular la respuesta del sistema inmunitario, atenuando procesos inflamatorios a nivel intestinal.
Posteriormente a estas investigaciones, Hermes y col. (2011), de la Universidad Autónoma de Barcelona, confirmaron en un estudio de laboratorio con una línea celular de epitelio intestinal porcino la gran capacidad del GMP de reducir la adhesión de ETEC K88 a las células porcinas.
Además, el equipo de Barcelona, corroboró en dichas células que el efecto antiinflamatorio del GMP se debe a una menor expresión génica de distintas citoquinas y quimioquinas proinflama- torias.
Más recientemente, en el mismo grupo investigador, González–Ortiz y col. (2013) han observado el efecto antiadherente del GMP a distintas concentraciones sobre ETEC K88 en cultivos de células epiteliales porcinas, poniéndose de manifiesto que dicho efecto es significativamente lineal.
Tras estas investigaciones in vitro, Hermes y col. (2013) realizaron una prueba in vivo en la cual se demostró que la inclusión de 1,5% de GMP en la dieta de lechones destetados reduce significativamente la población de ETEC K88 adherida a la mucosa intestinal, mientras que aumenta las poblaciones de lactobacilos.
→ Lactoferrina
La lactoferrina ejerce una actividad antimicrobiana y una acción inmunomoduladora.

Figura 2. La degradación parcial de la lactoferrina da lugar a péptidos bioactivos como la lactoferricina o la lactoferrampina con una actividad microbiana incluso superior a la de la lactoferrina .
La lactoferrina es una glicoproteína funcional de la familia de las transferrinas que se encuentra presente en la leche y tiene una alta capacidad de unirse al hierro de forma reversible, además de poseer actividad antibacteriana frente a gran variedad de microorganismos, actividad que puede ser ejercida mediante distintos mecanismos como el propio secuestro del hierro impidiendo su utilización por las bacterias, ciertas alteraciones en la pared bacteriana o la degradación e inactivación de proteínas de bacterias enteropatogénicas, necesarias para la colonización intestinal (Farnaud y Evans, 2003; Kovacs-Nolan y col., 2005; Ye y col., 2011).
Puede actuar como antiinflamatorio y estimular la respuesta inmunitaria, dependiendo del estado del animal (Yen y col., 2011), aunque los dos efectos contrapuestos de la lactoferrina, el antiin- flamatorio frente al inmunoestimulante, no están completamente dilucidados.
Ando y col. (2010) señalan que la naturaleza catiónica de la lactoferrina favorece su unión a los lipo- polisacáridos de las bacterias Gram negativo, impidiendo la formación de complejos entre dichos lipopolisacáridos y los receptores CD14 de los monocitos y otras células del sistema inmune, atenuando así aquellos procesos pro-inflamatorios inducidos por los lipopolisacáridos bacterianos.
Sin embargo, los mismos autores indican que la lactoferrina también puede unirse a los propios receptores CD14, facilitándose su unión a los complejos TLR-4/MD2, señalizadores y activadores de las respuestas a antígenos microbianos.
Legrand y col. (2004) indicaron que otro mecanismo de acción para el efecto antiinflamatorio de la lactoferrina implicaría la inhibición de la producción de varias citoquinas como elTNF-α o la interleuquina (iL)1β.
La degradación parcial de la lactoferrina por parte de la pepsina en el estómago da lugar a péptidos bioactivos como la lactoferricina o la lactoferram– pina con una actividad microbiana incluso superior a la de la lactoferrina (Ye y col., 2011).
Asimismo, la lactoferrina administrada oralmente puede ser absorbida en el intestino porcino (Liao y col. 2007), pasando a circulación sanguínea y pudiendo actuar en otros tejidos del organismo.
CON LOS AVANCES TECNOLÓGICOS OBTENIDOS EN INGENIERÍA GENÉTICA SE ESTÁN PRODUCIENDO A GRAN ESCALA LACTOFERRINA, LACTOFERRICINAY LACTOFERRAMPINA
La disponibilidad de cantidades masivas de calostro y leche en la industria lechera ha favorecido la obtención comercial de lactoferrina de origen bovino.
Sin embargo,con los avances tecnológicos obtenidos en ingeniería genética se están produciendo a gran escala lactoferrina, lactoferricina y lacto- ferrampina recombinantes de otras especies, entre ellas la porcina, en diversos organismos transgénicos como arroz, maíz, patata, ginseng, tabaco, vacas, cabras, gusanos de seda, levaduras (Aspergillus awamori y Pichia pastoris) o bacterias (Photorhabdus luminescens),(Drago, 2007; Tang y col., 2009, 2012; Cooper y col., 2014).
Numerosos trabajos científicos han demostrado en los últimos años el efecto positivo de la adición de lactoferrina o de sus péptidos funcionales en la dieta de lechones y cerdos de crecimiento sobre el perfil de la flora intestinal, la respuesta inmune, la morfología, la salud intestinal y el rendimiento productivo de los animales (Kuhara y col. 2006; Wang y col., 2006; Shan y col. 2007; Tang y col. 2009, 2012; Lee y col., 2010; Shan y col. 2012; Hu y col., 2012; Liu y col., 2013; Cooper y col., 2013,2014; Comstock y col. 2014).
Entre todas estas investigaciones cabe destacar la de Tang y col. (2009), quienes compararon el efecto de la adición de lactoferricina y lactoferrampina de origen biotecnológico en la dieta (100 ppm) de lechones destetados con el efecto de la inclusión de colistina en pienso (100 ppm) durante tres semanas.
Tanto la adición de ambos péptidos bioactivos como de colistina en la dieta, redujo significativamente los recuentos de ETEC en íleo, ciego y colon.

Tabla 1. Efecto de la inclusión en la dieta de péptidos bioactivos (lactoferricina + lacto- rrampina) o colistina sobre los parámetros productivos de los lechones (Tang y col., 2009).
Merece especial atención el hecho de que la evolución de los lechones que recibieron colistina en la dieta fue equivalente a la de los que recibieron lactoferricina y lactofe- rrampina, tanto a nivel zootécnico como a nivel sanitario (tabla 1 & Figura 3).


Figura 3. Efecto de la inclusión en la dieta de péptidos bioactivos (lac- toferricina + lactorrampina) o colistina sobre la incidencia de diarrea en los lechones. Los valores son medias con su error estándar representado en barras verticales. Las líneas con letras distintas difieren significativamente (p<0,05).
Asimismo, el mismo grupo investigador (Tang y col., 2012) evaluó posteriormente los efectos de la sustitución de la clortetraciclina por lactoferricina y lactoferrampina de origen biotecnológico en la dieta de lechones destetados a los 21 días de vida y observó que los animales que habían consumido la dieta suplementada con ambos péptidos (100 ppm), tras 3 semanas de prueba experimental, presentaban poblaciones de lactobacilos y bifi– dobacterias en yeyuno, íleo, colon y ciego signi- ficativamente superiores a las de los animales que habían recibido la dieta con el antibiótico.
El uso de la lactoferrina y de sus péptidos bioactivos en terapia antimicrobiana en ganado porcino ya fue con anterioridad motivo de estudio para Wang y col (2006) y Shan y col. (2007), obteniéndose siempre resultados prometedores.
Recientemente, Luna-Castro y col. (2014) evaluaron in vitro el efecto de lactoferrina bovina sobre el crecimiento in vitro y la virulencia del patógeno porcino Actinobacillus pleuropneumoniae y concluyeron que la lactoferrina bovina se podría usar para el tratamiento de infecciones por A. pleuropneumoniae en cerdos.
Además, los mismos autores indicaron que también se podría usar de forma preventiva en animales clínicamente sanos ya que, a con- centraciones inferiores a las antimicrobianas disminuye la adhesión de dicho patógeno a las células epiteliales porcinas y también su actividad proteasa.
→ Factor de crecimiento epidérmico
Otra familia de proteínas bioactivas que desde hace tiempo han suscitado el interés de numerosos grupos de investigación en medicina y nutrición humana, y cuya adición en la dieta de lechones ha sido, en menor medida, motivo de estudio en el campo de la nutrición animal son los llamados factores de crecimiento.
Éstos son polipéptidos mitogénicos, presentes en los fluidos corporales y particularmente en la leche de distintas especies.
Entre los factores de crecimiento podemos destacar el factor de crecimiento epidérmico (EGF), con el cual se han llevado a cabo diversas pruebas experimentales en lechones destetados. El EGF es un pequeño polipéptido que comprende 53 aminoácidos, cuyo contenido en la leche de la cerda es de 124 μg/litro.
Es bien sabido que el EGF induce la estimulación del crecimiento del epitelio del tractogastrointestinal en lechones (Jaeger y col., 1990; Zijlstray col., 1994).
Asimismo, Peng y col. (1997) estudiaron los niveles de EGF y de su receptor en distintos tejidos de cerdos a lo largo de su desarrollo, desde fetos de 90 días hasta animales de 180 días de vida, y concluyeron que el EGF parece jugar un papel importante en el desarrollo muscular de los cerdos en crecimiento.
Posteriormente, Schweiger y col. (2003) señalaron que la acción del EGF en ganado porcino no sólo es importante para la proliferación celular sino también para la diferenciación celular.
A nivel intestinal, estos mismos autores indicaron que la interacción del EGF con su receptor en la membrana de las células caliciformes estimula la secreción de mucinas, primera línea de defensa del epitelio intestinal.
El EGF resiste su paso por el tracto gastrointesti- nal (Zen y Su, 1996). Este polipétalo bioactivo ejerce su acción en el intestino al interaccionar con sus receptores específicos localizados en la membrana de los enterocitos, receptores que en los lechones se encuentran tanto en las microvellosidades como en la membrana basolateral de los enterocitos, por lo que su acción podrá ser directa sobre la superficie de la mucosa intestinal o también indirecta mediante translocación (Kelly y col., 1992).
La gran demanda de EGf para su uso como proteína funcional en medicina y nutrición humana ha llevado a un importante desarrollo de la producción biotecnológica del mismo por medio de la recombinación genética de EGf humano en levaduras y bacterias.
Y, aunque el uso de EGF en nutrición porcina todavía se encuentra en fases experimentales, el EGF porcino ya ha sido recombinado en Saccharomyces cerevisae (Pascal y col., 1991) y en Pichia pastoris (Lee y col. 2006).

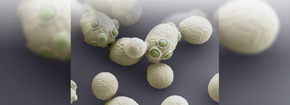
Figura 4 . Ejemplares de Saccharomyces cerevisae
Lee y col. (2006) observaron que la adición de 1,5 mg/ kg de EGF en el pienso de lechones destetados a los 14 días de vida mejoró significativamente la ganancia diaria durante los 7 primeros días después del destete, además de incrementar los niveles de igA en mucosa y suero, y estimular el desarrollo de la mucosa intestinal.

Tabla 2. Efecto de la suplementación de la dieta con EGF sobre la actividad enzimática en el intestino delgado de lechones precozmente destetados (Lee y col. , 2007). Todas las actividades enzimáticas se expresan como μmol/mg proteína/minuto Los valores con distintas letras difieren significativamente (p<0,05)
Posteriormente, Lee y col. (2007) evaluaron el efecto de la inclusión de distintos niveles de EGF porcino (0, 0,5, 1,0 o 1,5 mg/kg) en la dieta de lechones precozmente destetados sobre la morfología y la función intestinal (Tabla 2).

Ejemplares de EGF
La adición de EGF en la dieta estimuló significativamente algunas actividades enzimáticas en el tracto gastrointestinal de los lechones.
La aplicación práctica del EGF en nutrición porcina todavía requerirá de nuevas investigaciones para obtener mayor consistencia de los resultados con el objetivo de poder determinar la dosis y la pauta de administración adecuadas para obtener los efectos deseados en función de la edad de los animales y de su salud intestinal.
→ Inmunoglobulinas
Además de las proteínas y péptidos bioactivos abordados anteriormente en esta revisión, la leche también contiene inmunoglobulinas (IgG1, IgG2, IgA e IgM) que resisten a la digestión gástrica y ejercen un papel protector en el intestino.
Las inmunoglobulinas son capaces de prevenir la adherencia de bacterias patógenas a células epiteliales, de aglutinar bacterias, de neutralizar toxinas y de inactivar virus (Diehl–Jones y Askin, 2004).
Posteriormente, otros autores (Korhonen y col., 2000; Alexieva y col., 2004) han enfatizado la capacidad de los concentrados lácteos, producidos a partir de leche o calostro de vacas inmunizadas frente a un patógeno concreto, de prevenir o mejorar enfermedades infecciosas intestinales en animales jóvenes, aunque el desarrollo de estas prácticas en producción porcina requiera todavía de un mayor acervo científico.

Figura 6. La suplementación del pienso con inmunoglobulinas de origen bovino inmunizado frente a microorganismos causantes de la patología digestiva a tratar, protege a los animales de la enfermedad .
Es interesante señalar que actualmente ya se están comercializando concentrados lácteos con un alto contenido en anticuerpos frente a un patógeno concreto con el fin de tratar patologías digestivas en medicina humana.
Estos productos se obtienen a partir de leche o calostro, tras la inmunización de vacas gestantes frente a microorganismos causantes de la patología digestiva a tratar (Martínez y Martínez, 2006).
En porcino, el efecto de la adición de inmunoglo- bulinas de vacas inmunizadas contra una cepa de rotavirus bovino en la dieta de lechones infectados por rotavirus porcino fue estudiado por Lecce y col. (1991) y Shaker y col. (1992).
En ambos estudios se observó que la suplementación del pienso con inmunoglobulinas de origen bovino protegieron a los animales de la enfermedad, reduciéndose o eliminándose completamente tanto la excreción del virus como los cuadros diarreicos.
Inmunoglobulinas del plasma porcino
La suplementación de la dieta de lechones con plasma porcino es una práctica muy extendida en la fabricación de piensos compuestos cuyo interés viene avalado por numerosos estudios en los que se ha demostrado el efecto positivo de dicha suplementación sobre la respuesta inmune de los animales, su estructura intestinal, su microbiota y su rendimiento productivo (Gatnau y Zimmerman, 1994; Van Dijk y col., 2001, 2002; Owusu-Asiedu y col, 2002; Touchette y col., 2002; Markowska-Daniel y col., 2003; Frank y col., 2003; Torrallardona y col., 2003; Bosi y col. 2004; Yi y col, 2005; Pierce y col., 2005; Nofrarías y col. 2006; Zhao y col., 2007; Ferreira y col., 2009; Peace y col., 2011; Tucker y col., 2011; Tran y col. 2014).
Además de los efectos sobradamente comprobados en lechones, también se ha demostrado que la suplementación del pienso de lactación con 0,5% de plasma porcino repercute positivamente sobre la productividad de las cerdas lactantes (Frugé y col., 2009).
Así, Owusu-Asiedu y col (2002) estudiaron el efecto del contenido en inmunoglobulinas del plasma porcino de la dieta sobre el crecimiento de lechones durante dos semanas tras el destete y concluyeron que el contenido en inmunoglobulinas específicas frente a ETEC K88 y F18 es uno de los factores responsables del efecto positivo de la adición de plasma porcino en las dietas para lechones.
Posteriormente, Pierce y col. (2005) corroboraron el papel crucial de las inmunoglobulinas del plasma porcino en las mejoras productivas derivadas de la inclusión de dicho ingrediente en dietas para lechones y demostraron una eficacia superior del plasma porcino respecto al plasma bovino. De todas formas, desde 2005, el plasma comercializado para alimentación animal en Europa debe ser exclusivamente de origen porcino y haber sido obtenido en mataderos autorizados de la UE.

Figura 7. Inmunoglobulinas
LA MEJORA DEL ESTADO SANITARIO Y DEL RENDIMIENTO PRODUCTIVO DE LOS ANIMALES ALIMENTADOS CON DIETAS SUPLEMENTADAS CON PLASMA PORCINO PARECE SER DEBIDA AL CONTENIDO EN INMUNOGOBULINAS DEL PLASMA
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en nutriNews
REGISTRARME