
Em virtude da alta exigência nutricional, fruto da excelente produtividade tanto da galinha poedeira, quanto do frango de corte atual, esses animais necessitam de um trato digestório capaz de digerir e absorver com grande eficiência. O epitélio intestinal atua também como uma barreira natural contra microrganismos patogênicos e substâncias tóxicas que estão presentes no lúmen intestinal.
Sendo que, a população microbiana intestinal constitui um dos mais complexos ecossistemas da natureza, resultado de uma série de relações entre os microrganismos, o ambiente e o hospedeiro (AJUWON, 2015), a esse conjunto de indivíduos e associações, chamamos de microbioma.
Segundo Macari et al. (2002) a capacidade absortiva do intestino é diretamente proporcional ao tamanho das vilosidades do mesmo, estas vilosidades se constituem de dobramentos da mucosa em direção a luz do órgão, aumentando em centenas de vezes sua área de contato (Figura 1). O lúmen intestinal é revestido com uma única camada de células que passam por uma renovação rápida e contínua (SHIRAZI-BEECHEY et al., 2011). Essas células estão localizadas próximas à base das criptas do órgão e se diferenciam em vários tipos celulares que compõem o lúmen, cada uma contendo diferentes funções:

O vilo é a unidade funcional do intestino, existindo uma alta correlação positiva entre o tamanho da vilosidade e as taxas de absorção dos nutrientes. Já a profundidade da cripta é um indicador importante de saúde do trato gastrointestinal, uma vez que, quando o intestino é lesionado pela ação de microrganismos patogênicos há intensificação do turnover celular na cripta da vilosidade, provocando um aumento da sua profundidade.
Esse processo gera redução da relação entre o tamanho do vilo/profundidade da cripta, uma vez que o vilo irá diminuir seu tamanho, em resposta à lesão, enquanto a cripta aumentará sua profundidade, visando realizar a reparação das células do vilo, promovendo menor volume digestivo e das atividades de digestão e absorção (VISEK, 1978; FURLAN et al., 2004).
Portanto, a manutenção da integridade intestinal é de suma importância para a manutenção da sanidade da ave e das altas taxas produtivas. Na ocorrência de um processo infeccioso, microrganismos patogênicos degradam a mucosa intestinal, aumentando a quantidade de nutrientes necessários para o seu reparo e reduzindo a eficácia da absorção. Segundo Goddeeris (2002) o trato gastrointestinal já necessita naturalmente de um grande aporte de nutrientes para sua manutenção e renovação de celular (cerca de 23% a 36% do total de energia e 23% a 38% de toda a proteína em frangos de corte).
 Ocorrendo um processo infeccioso, microrganismos patogênicos degradam a mucosa, aumentando ainda mais a quantidade de nutrientes gastos para seu reparo, além disso, um epitélio lesado reduz a eficácia da absorção.
Ocorrendo um processo infeccioso, microrganismos patogênicos degradam a mucosa, aumentando ainda mais a quantidade de nutrientes gastos para seu reparo, além disso, um epitélio lesado reduz a eficácia da absorção.
Obled et al. (2002) apontam que nutrientes (principalmente os aminoácidos: treonina, triptofano e glutamina) são desviados de processos fisiológicos importantes para atuarem na síntese de mecanismos de defesa, deixando de serem utilizados para formação de produtos (carne e ovos).
| Microbiota Intestinal |
É comprovado que a presença de bactérias intestinais benéficas aumentam o desenvolvimento das criptas, a migração dos enterócitos e o comprimento das vilosidades no intestino delgado (XU e GORDON, 2003). Por outro lado, microrganismos patogênicos provocam efeito contrário, causam distúrbios no microbioma normal e no epitélio intestinal, alterando a permeabilidade dessa barreira natural facilitando a invasão de outros patógenos e de substâncias prejudiciais, que propiciarão alteração do metabolismo, e da capacidade de digerir e absorver nutrientes, culminando em processos inflamatórios crônicos (OLIVEIRA et al., 2000; PELICANO et al., 2005).
A colonização do trato gastrointestinal (TGI) por microrganismos se dá, já nos primeiros momentos após a eclosão do ovo, sendo que a partir do 4o dia existe um aumento na população microbiana que tende a se estabilizar na segunda semana de vida de acordo com as condições do ambiente de criação das aves (CANALLI et al, 1996; MAIORKA et al., 2001).
Existem cerca de 109 a 1014 bactérias/g de intestino das aves, a quantidade de células que constituem a microbiota intestinal é maior que o total de células que a própria ave possui provindas dos seus ossos, penas, bico, órgãos, sistemas, etc. Só esse grau de magnitude já demonstra a importância do microbioma para a saúde e homeostase da ave.
Essa população microbiana é composta principalmente por bactérias aeróbias facultativas (cerca de 90%), que são principalmente Bacillus, Bifidobacterium, Lactobacillus, (FULLER e COLE, 1989; MACARI e MAIORKA, 2000). O restante (cerca de 10%) consistem de Escherichia coli, Proteus spp., Clostridium spp., Staphylococcus spp., Blastomyces spp., Pseudomonas spp., entre outras, que em condições normais vivem em equilíbrio dentro do TGI (SAVAGE et al., 1997).
A microbiota pode viver tanto aderida ao epitélio, quanto em vida livre na luz intestinal e sua população é bastante dinâmica, podendo ser alterada por inúmeros fatores, como: dieta do hospedeiro, presença de O2, temperatura, pH, peristaltismo, produção de ácidos graxos voláteis (ácidos acético, butírico e propiônico), presença de antibióticos, entre outros (SAVAGE et al., 1997).
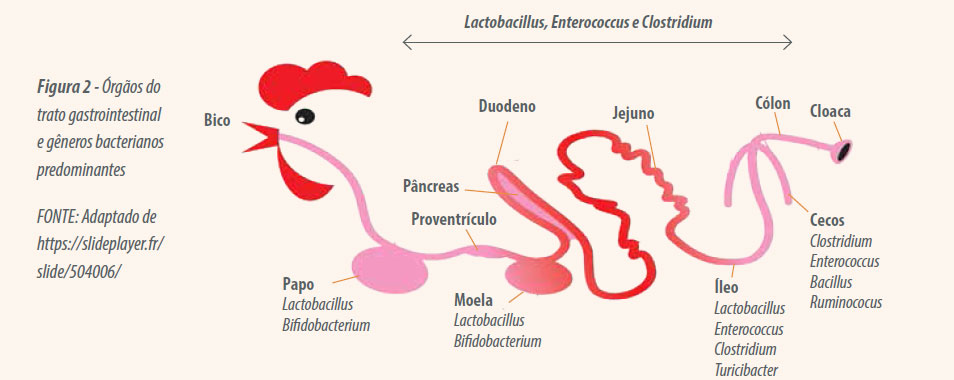
Segundo Saullu (2007), esta população é bastante variável também entre os órgãos do TGI (Figura 2), no papo (inglúvio) predominam Lactobacillus e Bifidobacterium, que produzem ácido lático e acético, reduzindo o pH e impedindo o crescimento de bactérias patogênicas. No proventrículo e na moela existe uma quantidade menor de microrganismos devido à baixa resistência ao pH extremante ácido desses órgãos (em torno de pH 2,5 no proventrículo e 3,5 na moela). Nos intestinos também ocorre colonização, sendo que a maior concentração de microrganismos se encontra no ceco (intestino grosso).
Por esses motivos se adicionam nas dietas de aves de produção aditivos que tenham a capacidade de promover maior saúde intestinal, através da modulação do microbioma intestinal, promovendo assim melhor desempenho, saúde, e qualidade de carne e ovos produzidos. Esses aditivos são chamados de aditivos zootécnicos equilibradores da microbiota intestinal (Compêndio brasileiro de nutrição animal, 2017).
| Antibióticos |
Existe uma ampla quantidade e variedade de aditivos que atuam promovendo maior saúde do trato gastrointestinal, e os mais comuns e utilizados na avicultura são os antibióticos melhoradores de desempenho, cujo seu início de uso na produção animal data da década de 1940 (NIEWOLD, 2007).[registrados]
Antibióticos como melhoradores do desempenho são substâncias administradas em produtos destinados à alimentação animal com a finalidade de melhorar a taxa de crescimento e/ou eficiência da conversão alimentar (Compêndio Brasileiro de Alimentação Animal, 2017). Os antibióticos atuam no lúmen intestinal (não sendo absorvidos), inibindo microrganismos responsáveis por infecções subclínicas e reduzindo inflamações no epitélio intestinal, através da diminuição do número de bactérias patogênicas, bem como sua adesão à mucosa intestinal (SOARES, 1996).

No entanto, a utilização indiscriminada pode exercer pressão de seleção em colônias bacterianas, permitindo o aparecimento de indivíduos cada vez mais resistentes aos
antibióticos (SCHNEIDER et al. 2011). Essa probabilidade provocou o banimento dessas substâncias pela União Europeia no ano de 2006, e restrições a muitos princípios ativos utilizados em países, grandes produtores de frangos e ovos, como Brasil e Estados Unidos.
A resistência microbiana ocorre quando as bactérias encontram maneiras de sobreviver aos antimicrobianos presentes no seu meio, modo este, que pode ser através de: menor absorção do antibiótico pela membrana da bactéria, minimizando ou impedindo totalmente o efeito; metabolizando o antibiótico em produtos não  nocivos ou transformando-o em um produto com o qual a bactéria possa coexistir (EDENS, 2003).
nocivos ou transformando-o em um produto com o qual a bactéria possa coexistir (EDENS, 2003).
As bactérias podem também transmitir essa resistência adquirida para outras (Quorum sensing). Cortez et al. (2006), estudando a resistência de 29 cepas de Salmonella spp. presentes em águas de escaldamento, evisceração e resfriamento, e nas carcaças, penas e fezes de frangos frente à ação de 12 antimicrobianos de uso comum na avicultura, concluíram que 86,2% das amostras foram resistentes ao aztreonam e à ampicilina, 72,4% à tetraciclina e 55,2% à amoxicilina/ácido clavulânico e sulfazotrim, atribui-se os resultados ao uso indiscriminado dos antibióticos.
Uma séria discussão deve ser levantada quando se trata da proibição de antibióticos como melhoradores de desempenho, visto que, o banimento dessas drogas em alguns casos não diminuiu a resistência microbiana e resultados observados em alguns países não se repetiram em outros, os casos de infecções provocadas pelos mesmos aumentaram, gerando piora na saúde e desempenho animal, e houve aumento do uso dos antibióticos com finalidade terapêutica (CASEWELL et al., 2003; CARDINAL et al., 2019).
Antibióticos administrados como terapêuticos não apenas matam as bactérias patogênicas alvo, mas também destroem a microbiota geral do hospedeiro, que às vezes resulta em desequilíbrio bacteriano levando a diarreia e infecção secundária, que possuem tratamento difícil (SULAKVELIDZE et al., 2001).
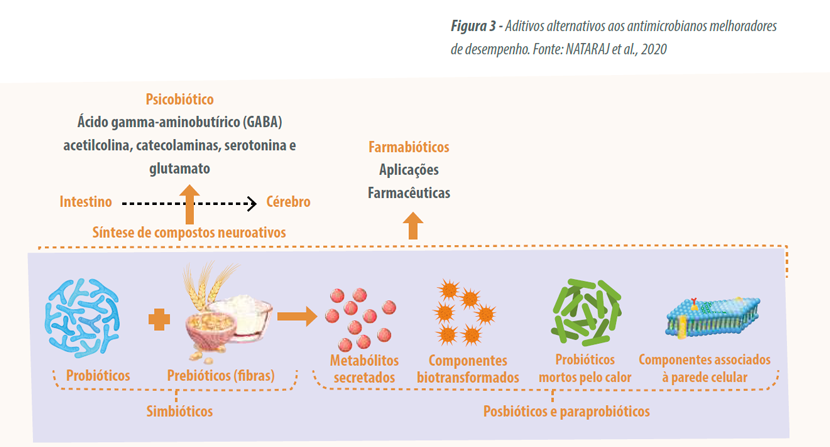
Devido a esse fato, vários aditivos alternativos (Figura 3) vêm sendo estudados e já utilizados para a substituir os antimicrobianos, objetivando reduzir o estabelecimento, a propagação e a produção de toxinas pelos microrganismos patogênicos que povoam o TGI, promovendo, portanto, maior saúde e integridade da mucosa do trato gastrointestinal, e permitindo maior digestão e absorção da dieta e seus nutrientes.
| Prebióticos |
Segundo o Compêndio Brasileiro de Alimentação Animal (2017), os prebióticos não são digeríveis por bactérias patogênicas e nem pelas aves, sendo digeríveis por algumas bactérias benéficas. Esses produtos têm um efeito benéfico sobre o hospedeiro, estimulando seletivamente o crescimento e atividade de uma ou mais bactérias benéficas do cólon, melhorando a saúde intestinal do seu hospedeiro.
As principais fontes de prebióticos são alguns açúcares absorvíveis ou não, fibras, peptídeos, proteínas, álcoois de açúcares e os oligossacarídeos, especialmente os frutoligossacarídeos (FOS), glucoligossacarídeos (GOS) e mananoligossacarídeos (MOS), sendo eles aditivos de rações para animais não ruminantes, mas operando de maneira distinta (MACARI e FURLAN, 2005).
Os GOS servem como substrato para bactérias do gênero Bifidobacterium, entretanto, eles não são absorvíveis por espécies de Clostridium e Salmonella, favorecendo a proliferação de espécies benéficas em detrimento das patogênicas, fenômeno conhecido como exclusão competitiva (IJI e TIVEY, 1998).

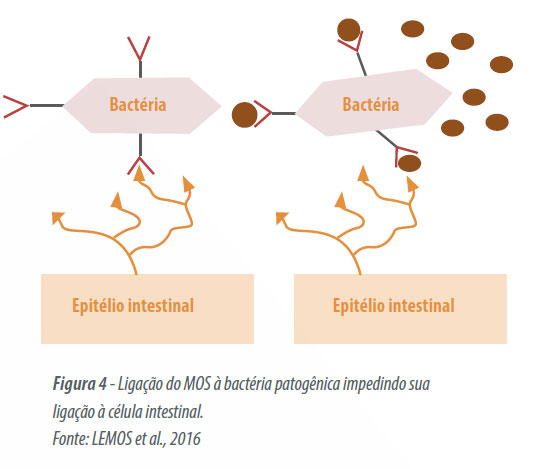
O oligossacarídeo de manose (MOS) opera por um mecanismo mais complexo, sendo este derivado da parede celular interna de leveduras Saccharomyces cerevisae. Para uma bactéria iniciar o processo infeccioso é necessário que ela consiga aderir-se à superfície epitelial. Esta adesão ocorre através de glicoproteínas (lectinas) formando uma estrutura de glicocálix ou fímbrias, o MOS satura os sítios de ligação das bactérias patogênicas impedindo a adesão à mucosa intestinal (Figura 4), livre no lúmen estas são eliminadas através dos movimentos peristálticos junto com as excretas (MACARI e MAIORKA, 2000).
Outra forma de atuação do MOS é através do seu efeito sobre o sistema imunológico, modulando e preparando o sistema imune para o processo infeccioso. Spring e Privulescu (1998) constataram aumento de cerca de 25% de níveis de IgA secretória, quando foi adicionado MOS na ração de frangos de corte, também foi observado aumento na resposta de macrófagos.
Resultados benéficos do uso de prebióticos em dietas de frangos de corte são largamente difundidos na literatura científica (ROSEN, 2006; SOHAIL et al., 2012; REHMAN et al. 2020).
Em galinhas poedeiras o uso de prebiótico melhorou a produção de ovos, aumentou a atividade da amilase pancreática e diminuiu a concentração de colesterol na gema (CHEN et al., 2005), promoveu maior absorção de minerais, sobre tudo de cálcio e fósforo, refletindo em uma melhor casca dos ovos (ŚWIĄTKIEWICZ et al., 2010a) e maior resistência óssea (ŚWIĄTKIEWICZ et al., 2010b), aumentou a contagem de Bifidobacterium spp. cecal e reduziu a de Clostridium perfringens (PINEDA-QUIROGA et al., 2017).
| Probióticos |
Probióticos podem ser definidos como microrganismos não patogênicos, sem limitações técnicas para espécie, categoria e idade do animal. Sendo utilizados como reguladores da microbiota intestinal (COMPÊNDIO BRASILEIRO de ALIMENTAÇÃO ANIMAL, 2017).
Para ser considerado probiótico, um microrganismo deve preencher aos seguintes requisitos, segundo Fuller e Cole (1989):
- fazer parte do microbiona intestinal normal;
- sobreviver e colonizar rapidamente o intestino;
- ser capaz de aderir ao epitélio intestinal do hospedeiro; sobreviver à ação das enzimas digestivas; ter ação antagonista aos microrganismos patogênicos; não ser tóxico e/ou patogênico;
- ser cultivável em escala industrial;
- ser estável e viável na preparação comercial e estimular a imunidade.
Os principais microrganismos utilizados como probióticos são dos gêneros Lactobacillus, Bifidobacterium, Enterococcus, Streptococcus, Bacillus e também leveduras,
podendo ser usados separadamente ou em combinações entre eles.
Lactobacillus e Bifidobacterium têm sido utilizados mais extensivamente em humanos, enquanto espécies de leveduras, Bacillus, Enterococcus e Saccharomyces têm sido
os organismos mais comuns usados na alimentação animal (SALMINEN et al., 1998).
Esses aditivos podem atuar de várias formas no intestino (Figura 5), através da exclusão competitiva, pela incorporação de um número maior de indivíduos
(CORCIONIVOSCHI et al., 2010); do antagonismo direto, através da produção de ácidos orgânicos e outras substâncias bactericidas, essa acidificação também promove um efeito nutricional, que permite maior absorção de ácidos graxos de cadeia curta e digestão de fibras (CHOCT, 2004); microrganismos probióticos também estimulam o sistema imunológico, por ativação de macrófagos, proliferação de células T, produção de interferon e mucinas (LEEDLE, 2000).
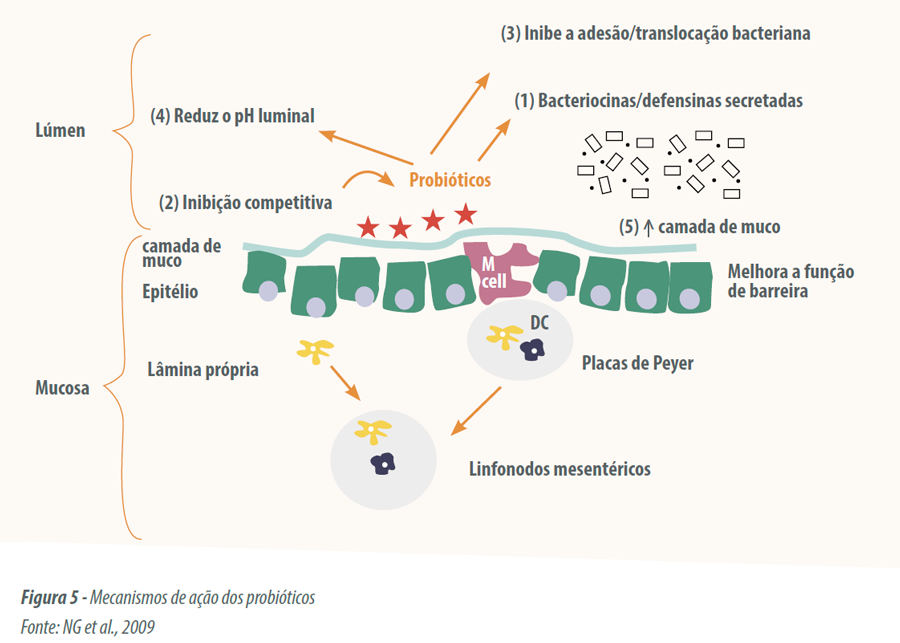
Por todos esses fatores há maior saúde do trato digestório, melhorando a digestão e absorção dos nutrientes e propiciando redução na concentração de amônia nas excretas de frangos de corte e galinhas poedeiras.
Espécies probióticas pertencentes aos gêneros Lactobacillus, Streptococcus, Bacillus, Bifidobacterium, Enterococcus, Aspergillus e Saccharomyces têm um comprovado efeito benéfico sobre o desempenho do frango de corte, podendo substituir os antibióticos avilamicina e colistina nas rações sem perdas de desempenho (ROCHA et al., 2010).
Os probióticos em galinhas de postura podem promover: melhoria na digestibilidade ileal da maioria dos aminoácidos essenciais, com a exceção de histidina e fenilalanina, e promovem maiores concentrações séricas de IgA e IgM (ZHANG e KIM, 2014), melhor desempenho e qualidade dos ovos, além de reduzir os níveis de colesterol na gema, devido à maior secreção de sais biliares, sendo esses sintetizados a partir de colesterol no fígado (MIKULSKI et al., 2012).
| Simbióticos |
São misturas de probióticos e prebióticos que afetam beneficamente o hospedeiro melhorando a sobrevivência e implantando suplementos vivos no trato gastrointestinal (COMPÊNDIO BRASILEIRO de ALIMENTAÇÃO ANIMAL, 2017). Esses aditivos quando fornecidos de forma conjunta, em um mesmo produto, tem ação sinérgica melhorando o desempenho das aves, sem deixar resíduo nas carcaças.
Segundo Ferket et al. (2002), quando prebióticos e probióticos são administrados juntos ocorre uma manutenção da saúde do trato gastrointestinal, praticamente impossibilitando o estabelecimento de E. coli, Clostridium ou Salmonella.

Ashraf et al. (2013) observaram que frangos de corte quando submetidos a estresse térmico (35ºC de temperatura e 75% integridade da mucosa intestinal quando receberam simbióticos na ração. Tang et al. (2017), fornecendo prebiótico, probiótico e simbiótico, para poedeiras semipesadas, observou melhor consumo e a produção de ovos de 20 a 36 semanas de idade.
receberam simbióticos na ração. Tang et al. (2017), fornecendo prebiótico, probiótico e simbiótico, para poedeiras semipesadas, observou melhor consumo e a produção de ovos de 20 a 36 semanas de idade.
É importante a seleção correta dos microrganismos escolhidos como probióticos, a dose utilizada, as fontes prebióticas e uma combinação de todos esses aspectos (CHAMBERS e GONG, 2011), assim como a via de administração e o estado sanitário do plantel, visto que no ambiente do trato gastrointestinal, a população existente e as relações entres os indivíduos são extremamente complexas.
Cada um desses fatores tem grande importância para a eficácia do simbiótico, fazendo com que existam discrepâncias entre os resultados dos diferentes autores. Outras combinações simbióticas podem ser possíveis à medida que se aprende mais sobre a digestibilidade dos frangos de corte e das galinhas poedeiras, com possibilidade de uso de outros nutrientes com outras funções benéficas para o hospedeiro (RICKE, 2018).
No entanto, alguns problemas também têm sido relacionados ao uso de probióticos, prebióticos e simbióticos, como o aparecimento de bactérias probióticas resistentes à drogas, interferência desses aditivos de forma prejudicial no microbioma do hospedeiro e falta de eficácia dos mesmos. Portanto novos produtos e conceitos têm sido desenvolvidos como os posbióticos e paraprobióticos (ou parabióticos).
Posbióticos podem ser definidos como produtos bacterianos ou metabólicos de microrganismos que têm atividade biológica no hospedeiro, como enzimas, proteínas
secretadas, ácidos graxos de cadeia curta, vitaminas, aminoácidos, peptídeos, ácidos orgânicos.
Paraprobióticos são células microbianas não viáveis (integra ou fragmentada) ou extratos celulares brutos que estimulam positivamente a mucosa intestinal e o microbioma.
Ambos têm alta relação benéfica com os microrganismos já presentes na microbiota intestinal benéfica favorecendo sua proliferação e sobrevivência. Por se tratarem de novos aditivos, ambos ainda necessitam de mais pesquisas e definições de recomendações quanto suas dosagens e substratos a serem
utilizados para que tenham máxima eficácia (NATARAJ et al., 2020).
| Considerações Finais |
Não há comprovações científicas de que o uso de antibióticos como aditivo melhorador de desempenho tenha gerado resistência microbiana, no entanto seu uso indiscriminado pode ter contribuído para tal fato.
A pesar de sua eficácia comprovada tecnicamente, o estudo de aditivos equilibradores da microbiota intestinal nas rações de frango de corte e galinhas poedeiras tem produzido resultados contrastantes, devido ao baixo desafio das instalações experimentais, diferentes dosagens, produtos e protocolos experimentais.
Novos aditivos vêm sendo estudados, no entanto, mais pesquisas são necessárias para validar esses produtos. Regulamentações e registros devem ser estabelecidos visando que uma gama cada vez maior de produtos esteja disponível para utilização na produção avícola, com segurança e efetividade.
Cabe ressaltar que somente a substituição dos antibióticos por outros aditivos que desempenham função semelhante, não são certeza de manutenção ou melhoria da saúde intestinal. O uso de aditivos é apenas um dos elementos que contribui para esse fato, devendo a análise ser feita de maneira holística no ambiente produtivo, e fatores como ambiência, condição das instalações, protocolos de biosseguridade, densidade de criação, qualidade nutricional e microbiológica dos ingredientes das dietas, exigências nutricionais, sanidade da matriz, etc., são fatores de igual importância.
Autores:
Túlio Leite Reis1
Flávio Medeiros Vieites2
1Universidade Federal Rural do Rio de Janeiro (UFRRJ). E-mail: [email protected];
2Universidade Federal de Juiz de Fora (UFJF). E-mail: [email protected].
AJUWON, K.M. Toward a better understanding of mechanisms of probiotics and prebiotics action in poultry species. Journal of Applied Poultry Research, v.25, n.2, p.277- 283, 2015.
ASHRAF, S.; ZANEB, H.; YOUSAF, M.S.; IJAZ, A.; SOHAIL, M.U.; MUTI, S.; REHMAN, H. Effect of dietary supplementation of prebiotics and probiotics on intestinal microarchitecture in broilers reared under cyclic heat stress. Journal of Animal Physiology and Animal Nutrition, v. 97, p.68-73, 2013.
CANALLI, L. S.; FLEMMING, J.S.; MIRA, R.T.; BASILE, L.F. Alteração da microbiota intestinal de frangos de corte pela utilização de um probiótico na alimentação. Revista do Setor de Ciências Agrárias, v. 15, n.1, p.125-133, 1996.
CARDINAL, K. M.; KIPPER, M.; ANDRETTA, I.; RIBEIRO, A.M.L. Withdrawal of antibiotic growth promoters from broiler diets: Performance indexes and economic impact. Poultry science, v. 98, v. 98, n. 12, p. 6659-6667, 2019.
CASEWELL, M.; FRIIS, C.; MARCO, E.; MCMULLIN, P.; PHILLIPS, I. The European ban on growth-promoting antibiotics and emerging consequences for human and animal health. Journal of Antimicrobial Chemotherapy, v.52, p.159–161, 2003.
CHAMBERS, J.R.; GONG, J. The intestinal microbiota and its modulation for Salmonella control in chickens. Food Research International, v.44, n.10, p.3149-3159, 2011.
CHEN, Y.C.; NAKTHONG, C.; CHEN, T.C. Effect of chicory fructans on egg cholesterol in commercial laying hen. International Journal of Poultry Science, v.4, p.109–114, 2005.
CHENG, H.; LEBLOND, C.P. Origin, differentiation and renewal of the four main epithelial cell types in the mouse small intestine I. Columnar cell. Developmental Dynamics, v. 141, n. 4, p. 461-479, 1974.
CHOCT, M. Effects of organic acids, prebiotics and enzymes on control of necrotic enteritis and performance of broiler chickens. University of New England Armidale, p.27- 01, 2004.
COMPÊNDIO BRASILEIRO DE ALIMENTAÇÃO ANIMAL. São Paulo: Sindirações/Anfal. Campinas CBNA/SDR/MA. 2017. 371p.
CORCIONIVOSCHI, N.; DRINCEANU, D.; POP, I.M.; STACK, D.; ŞTEF, L.; JULEAN, C.; BOURKE, B. The effect of probiotics on animal health. Scientific Papers Animal Science and Biotechnologies, v.43, n.1, p.35-41, 2010.
CORTEZ, A.L.L.; CARVALHO, A.C.F.B.; IKUNO, A.A.; BÜRGER, K.P.; VIDALMARTINS, A.M.C. Resistência antimicrobiana de cepas de Salmonella spp. isoladas de abatedouros de aves. Arquivos do Instituto Biológico, v.73, n.2, p.157-163, 2006.
EDENS, F.W. An alternative for antibiotic se in poultry: probiotics. Revista Brasileira de Ciência Avícola, v.5, n.2, p.75-97, 2003.
FERKET, P.R.; PARKS, C.W.; GRIMES, J.L. Benefits of dietary antibiotic and annanoligosaccharide supplementation for poultry. In: Multi-State Poultry Meeting, Anais… Indianopolis: University of Illinois, 2002.
FULLER, R.; COLE, C.B. The scientific basis of the Probiotic concept in probiotics. Theory and Applications. B.A. Stark and J.M. Wilkinson. 1ª ed., Chalcombe. Publications, 1989. 14p.
FURLAN, R.L.; MACARI, M.; LUQUETTI, B.C. Como avaliar os efeitos do uso de prebióticos, probióticos e flora de exclusão competitiva. In: 5º Simpósio Técnico de Incubação, Matrizes de Corte e Nutrição, Anais… Balneário Camboriú (SC), p. 6-28, 2004.
GODDEERIS, B. M.; BOERSMA, W. J. A.; COX, E.; VAN DER STEDO; KOENEN, M. E. VANCAENEGHEM, S.; MAST J.; VAN D. Nutrition and Health of the Gastrointestinal Tract in Poultry. Wageningen Academic Publishers, p 97 – 134, 2002.
LEEDLE, J. Probiotics and DFMs-mode of action in the gastrointestinal tract. In: Simpósio Sobre Aditivos Alternativos na Nutrição Animal, Anais… Campinas (SP): Colégio Brasileiro de Nutrição Animal, p. 25-40, 2000.
LEMOS, M.J.D.; CALIXTO, L.F.L.; TORRES-CORDIDO, K.A.A.; REIS, T.L., 2016. Uso de aditivo alimentar equilibrador da flora intestinal em aves de corte e de postura. Arquivos do Instituto Biológico, v. 83, 2016.
SOHAIL, M.U.; HUME, M.E.; BYRD, J.A.; NISBET, D.J.; IJAZ, A.; SOHAIL, A.; SHABBIR, M.Z.; REHMAN, H. Effect of supplementation of prebiotic mannan-oligosaccharides and probiotic mixture on growth performance of broilers subjected to chronic heat stress. Poultry Science, v.91, n.9, 2012.
MACARI, M.; FURLAN, R. L. Probióticos. In: Conferência Apinco de Ciência e Tecnologia Avícolas Santos, Anais… Campinas (SP): FACTA, v.1, p. 53-71, 2005.
MACARI, M.; MAIORKA, A. Função gastrintestinal e seu impacto no rendimento avícola. In: Conferência Apinco De Ciência e Tecnologia Avícolas, Anais… Campinas (SP): FACTA, p.161-174, 2000.
MAIORKA, A.; SANTIN, E.; SUGETA, S.M.; ALMEIDA, J.G.; MACARI, M. Utilização de prebióticos, probióticos ou simbióticos em dietas para frangos. Revista Brasileira de Ciência Avícola, v.3, p.75-82, 2001.
MASSEY‐HARROCHE, Dominique. Epithelial cell polarity as reflected in enterocytes. Microscopy Research and Technique, v. 49, n. 4, p. 353-362, 2000.
MIKULSKI, D.; JANKOWSKI, J.; NACZMANSKI, J.; MIKULSKA, M.; DEMEY, V. Effects of dietary probiotic (Pediococcus acidilactici) supplementation on performance, nutrient digestibility, egg traits, egg yolk cholesterol, and fatty acid profile in laying hens. Poultry science, v.91, n.10, p.2691-2700, 2012.
NATARAJ, B.H.; ALI, S.A.; BEHARE, P.V.; YADAV, H. Postbiotics-parabiotics: the new horizons in microbial biotherapy and functional foods. Microbial cell factories, v. 19, n. 1, p. 1-22, 2020.
NG, S.C.; HART, A.L.; KAMM, M.A.; STAGG, A.J.; KNIGHT, S.C. Mechanisms of Action of Probiotics: Recent Advances. Inflammatory bowel diseases, v. 15, n. 2, p. 300-310, 2009.
NIEWOLD, T.A. The nonantibiotic anti-inflammatory effect of antimicrobial growth promoters, the real mode of action? A hypothesis. Poultry Science, v.86, n.4, p.605-609, 2007.
OBLED, C. Aminoacids: Meat, Milk & More. Canadian Society Animal Science. p. 55 – 63, 2002.
OLIVEIRA, P.B.D.; MURAKAMI, A.E.; GARCIA, E.R.D.M.; MACARI, M.; SCAPINELLO, C. Influência de fatores antinutricionais da Leucena (Leucaena leucocephala e Leucaena cunningan) e do feijão guandu (Cajanus cajan) sobre o epitélio intestinal e o desempenho de frangos de corte. Revista Brasileira de Zootecnia, v. 29, n. 6, p. 1759-1769, 2000.
OTUTUMI, L.K.; DE MORAES GARCIA, E.R.; GÓIS, M.B.; LODDI, M.M.. Variations on the efficacy of probiotics in poultry. Probiotic in animals, p. 272, 2012.
PELICANO, E.R.L.; SOUZA, P.A.; SOUZA, H.B.A.; FIGUEIREDO, D.F.; BOIAGO, M.M.; CARVALHO, S.R.; BORDON, V.F. Intestinal mucosa development in broiler chickens fed natural growth promoters. Revista Brasileira de Ciência Avícola, v. 7, n. 4, p. 221-229, 2005.
PINEDA-QUIROGA, C.; ATXAERANDIO, R.; ZUBIRIA, I.; GONZALEZ-POZUELO, I.; HURTADO, A.; RUIZ, R.; GARCIA-RODRIGUEZ, A. Productive performance and cecal microbial counts of floor housed laying hens supplemented with dry whey powder alone or combined with Pediococcus acidilactici in the late phase of production. Livestock Science, v.195, p.9-12, 2017.
REHFELD, J.F. A centenary of gastrointestinal endocrinology. Hormone and Metabolic Research, v. 36, n. 11/12, p. 735-741, 2004.
REHMAN, A. et al. Dietary effect of probiotics and prebiotics on broiler performance, carcass, and immunity. Poultry Science, v. 99, n. 12, p. 6946-6953, 2020.
RICKE, S.C. Impact of Prebiotics on Poultry Production and Food Safety. Yale Journal of Biology and Medicine, v.91, p.151-159, 2018.
ROCHA, A.P.; ABREU, R.D.; MARQUES DA COSTA, M.D.C.M.; DE OLIVEIRA, G.J.C.; ALBINATI, R.C.B.; DA PAZ, A.S.; PEDREIRA, T.M. Prebióticos, ácidos orgânicos e probióticos em rações para frangos de corte. Revista Brasileira de Saúde e Produção Animal, v.11, n.3, 2010.
ROSEN, G.D. Holo-analysis of the efficacy of Bio-Mos® in broiler nutrition. British Poultry Science, v.48, n.1, 2006.
SALMINEN, S.; BOULEY, C.; BOUTRON-RUAULT, M.C.; CUMMINGS, J.H.; FRANCK, A.; GIBSON, G.R.; ROWLAND, I. Functional food science and gastrointestinal physiology and function. British Journal of Nutrition, v.80, p.147-171, 1998.
SAULLU, J. Saúde intestinal das aves e suas interações. 2007. Disponível em:http://www.nucleoestudo.ufla.br/necta/novo/palestras/saude_intestinal_da_ave_e_su as_iteracoes.pdf. Acessado em: 23/01/2011.
SAVAGE, T.F.; ZAKREWSKA, E.I.; ANDREASEN, J.R. The effects of feeding mannan oligosaccharide supplemented diets to poults on performance and the morphology of the small intestine. Poultry Science, v.76, p.139, 1997.
SCAPINELLO, C.; FARIA, H.G.; FURLAN, A.L.; MICHELAN, A.C. Efeito da utilização de oligossacarídeo manose e acidificantes sobre o desempenho de coelhos em crescimento. Revista Brasileira de Zootecnia, v.30, p.1272-1277, 2001.
SCHNEIDER, R.N.; NADVORNY, A.; SCHMIDT, V. Perfil de resistência antimicrobiana de isolados de Escherichia coli obtidos de águas superficiais e subterrâneas, em área de produção de suínos. Biotemas, v.22, n.3, p.11-17, 2011.
SHIRAZI-BEECHEY, S.P.; MORAN, A.W.; BRAVO, D.; AL-RAMMAHI, M. Nonruminant Nutrition Symposium: intestinal glucose sensing and regulation of glucose absorption: implications for swine nutrition. Journal of Animal Science, v. 89, n. 6, p. 1854-1862, 2011.
SOARES, L.L.P. Restrições e uso de aditivos (promotores de crescimento) em ração de aves: Visão do fabricante. In: Conferência Apinco de Ciência e Tecnologia Avícola, Anais… Curitiba(PR): Apinco, p.27-36, 1996.
SPRING, P.; PIRVULESCU, M. Mannanoligosaccharide: Its logical role as natural feed additive for piglets, Norttingham, In: Biotechnology in The Feed Industry Annual Symposium, Anais… Norttingham: Norttingham University Press, p 553. 1998.
SULAKVELIDZE, A.; ALAVIDZE, Z.; MORRIS, J.G. Bacteriophage therapy. Antimicrobial Agents & Chemotherapy, v.45, p.649-659, 2001.
ŚWIĄTKIEWICZ, S.; KORELESKI, J.; ARCZEWSKA, A. (2010a) Laying performance and eggshell quality in laying hens fed diets supplemented with prebiotics and organic acids. Czech Journal of Animal Science, v.55, n.7, p.294-304, 2010.
ŚWIĄTKIEWICZ, S.; KORELESKI, J.; ARCZEWSKA, A. Effect of organic acids and prebiotics on bone quality in laying hens fed diets with two levels of calcium and phosphorus. Acta Veterinaria Brno, v.79, n.2, p.185-193, 2010.
TANG, S.G.H.; SIEO, C.C.; RAMASAMY, K.; SAAD, W.Z., WONG, H.K.; HO, Y.W. Performance, biochemical and haematological responses, and relative organ weights of laying hens fed diets supplemented with prebiotic, probiotic and synbiotic. BMC Veterinary Research, v.13, n.1, p.248, 2017.
VISEK, W. J. The mode of growth promotion by antibiotics. Journal of Animal Science, v. 46, n. 5, p. 1447-1469, 1978.
XU, J.; GORDON, J.I. Honor thy symbionts. Proceedings of the National Academy of Sciences, v. 100, n. 18, p. 10452-10459, 2003.
ZHANG, Z.F.; KIM, I.H. Effects of multistrain probiotics on growth performance, apparent ileal nutrient digestibility, blood characteristics, cecal microbial shedding, and excreta odor contents in broilers. Poultry Science, v.93, n.2, p.364-370, 2014.
[/registrados]
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar esta publicação e muito mais conteúdo especializado. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em nutriNews
REGISTRE-SE















