Importância dos microminerais na avicultura
![]()
Os microminerais são essenciais para o crescimento e diversos processos metabólicos em organismos vivos. Eles atuam principalmente como catalisadores ou constituintes dos sistemas enzimáticos de muitas células e possuem importância reconhecida em processos imunológicos e reprodutivos.
A disponibilidade de minerais nas matérias-primas de origem vegetal, bem como de fontes inorgânicas tradicionais, ou seja, óxidos, sulfatos ou carbonatos, é relativamente baixa, enquanto as necessidades de linhas modernas e de alta produção de galinhas poedeiras e frangos de corte para os microminerais são altos.
Deste modo, a suplementação de microminerais é uma questão importante na nutrição avícola moderna (Swiatkiewicz et al., 2014).
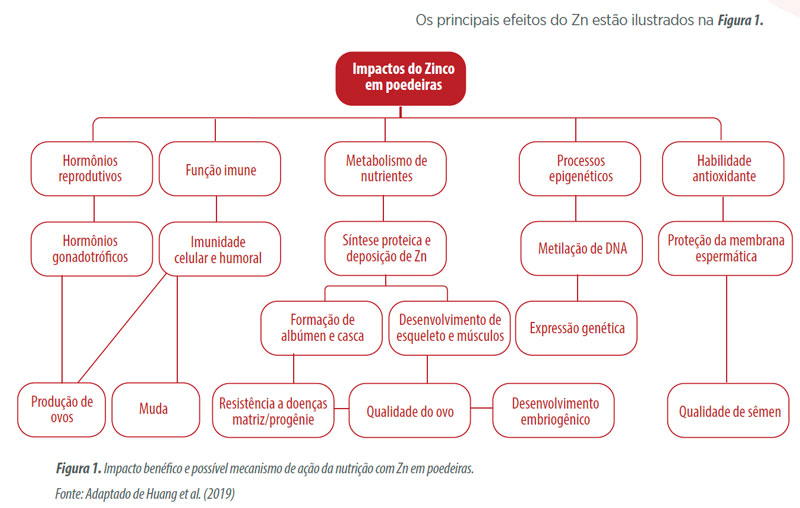
A seguir serão expostos com mais detalhes três dos principais microminerais suplementados na dieta de aves, zinco, manganês e cobre.

O zinco, é um dos microminerais essenciais para organismos vivos.
Os principais processos mediados pelo Zn afetam a:
| Síntese de proteínas | |
| Proliferação celular | |
| Expressão gênica | |
| Síntese de hormônios endócrinos | |
| Imunidade e reprodução (Huang et al., 2019). |
Além disso, o Zn é um cofator de mais de 200 enzimas funcionando em diversos processos fisiológicos, incluindo imunidade, habilidades antioxidantes e processos
epigenéticos (Pierce, 2013). O modo de ação do Zn em aves inclui:
![]() manutenção do crescimento normal, incluindo o desenvolvimento do esqueleto e penas, bem como saúde da pele e dos pés;
manutenção do crescimento normal, incluindo o desenvolvimento do esqueleto e penas, bem como saúde da pele e dos pés;
![]() resistência a doenças infecciosas e melhora do sistema imunológico;
resistência a doenças infecciosas e melhora do sistema imunológico;
![]() metabolismo de carboidratos, proteínas e lipídios aumentando a desidrogenase glutâmica, álcool desidrogenase, fosfatase alcalina e polimerase de RNA;
metabolismo de carboidratos, proteínas e lipídios aumentando a desidrogenase glutâmica, álcool desidrogenase, fosfatase alcalina e polimerase de RNA;
![]() habilidade antioxidante; e
habilidade antioxidante; e
![]() influência na expressão genética.
influência na expressão genética.
Em aves poedeiras e reprodutoras, a suplementação dietética de Zn tem efeitos positivos na produção de ovos por regular a secreção de hormônios reprodutivos e a síntese de proteínas durante a formação de ovos (Tabatabaie, et al., 2007).
 O Zn também desempenha um importante papel na qualidade da casca do ovo, estando envolvido na síntese da membrana da casca ao afetar a estrutura do epitélio no istmo, e atuando como um cofator da enzima anidrase carbônica (AC) (Innocenti et al., 2004).
O Zn também desempenha um importante papel na qualidade da casca do ovo, estando envolvido na síntese da membrana da casca ao afetar a estrutura do epitélio no istmo, e atuando como um cofator da enzima anidrase carbônica (AC) (Innocenti et al., 2004).
A maioria do Zn do ovo está depositado na gema, e aproximadamente 86% do Zn originalmente presente no ovo fertilizado é transferido para os pintos (Richards, 1997).
Consequentemente, a deficiência de Zn em reprodutoras pode alterar o estado fisiológico dos pintos descendentes influenciando no seu peso corporal, qualidade da carne, status antioxidante e imunidade (Hudson et al., 2004; Hudson et al., 2005; Zhu et al., 2017). Portanto, a deposição de Zn em óvulos maternos é necessária para o crescimento e completo desenvolvimento dos embriões.
![]() Ao fornecer dietas suplementadas com Zn para reprodutoras ou via injeção in ovo com Zn, não só houve redução da mortalidade de pintinhos, mas também ocorreu melhora no desempenho pós-eclosão (Hassan, 2018; Zhu et al., 2017).
Ao fornecer dietas suplementadas com Zn para reprodutoras ou via injeção in ovo com Zn, não só houve redução da mortalidade de pintinhos, mas também ocorreu melhora no desempenho pós-eclosão (Hassan, 2018; Zhu et al., 2017).
![]() Além disso, a suplementação de Zn em reprodutoras aumentou o desenvolvimento músculo esquelético por aumento na síntese de proteínas e inibição da degradação de proteínas na prole (Gao et al., 2014).
Além disso, a suplementação de Zn em reprodutoras aumentou o desenvolvimento músculo esquelético por aumento na síntese de proteínas e inibição da degradação de proteínas na prole (Gao et al., 2014).
Deficiência severa de Zn em dietas de galinhas resultam em baixas taxas de eclodibilidade, embriões com desenvolvimento anormal e com baixo desempenho.
(Blamberg et al., 1960; Zhu et a., 2017). Entretanto, a suplementação materna de Zn ou injeções in ovo podem eliminar esses efeitos adversos (Sun et al., 2018).
![]() In vitro, a deficiência de Zn afetou negativamente o crescimento e diferenciação do sistema nervoso nas fases iniciais do desenvolvimento embrionário (Iniguez et al., 1978). Embora alguns pesquisadores tenham demonstrado que a deficiência de Zn resultou em pouco ou nenhum efeito na produção de ovos, a eclodibilidade e desempenho da prole pode ser influenciada negativamente. Por esta razão, o requisito ideal de Zn para a produção de ovos, desenvolvimento embrionário e
In vitro, a deficiência de Zn afetou negativamente o crescimento e diferenciação do sistema nervoso nas fases iniciais do desenvolvimento embrionário (Iniguez et al., 1978). Embora alguns pesquisadores tenham demonstrado que a deficiência de Zn resultou em pouco ou nenhum efeito na produção de ovos, a eclodibilidade e desempenho da prole pode ser influenciada negativamente. Por esta razão, o requisito ideal de Zn para a produção de ovos, desenvolvimento embrionário e![]() desempenho de pintos provenientes de galinhas reprodutoras ainda não está claro.
desempenho de pintos provenientes de galinhas reprodutoras ainda não está claro.
As diferenças entre os estudos podem depender de:[registrados]
![]() Diferenças nas fontes e níveis de Zn;
Diferenças nas fontes e níveis de Zn;
![]() Conteúdo de Zn basal nas dietas e período experimental;
Conteúdo de Zn basal nas dietas e período experimental;
![]() Diferenças genéticas; Idade e estado fisiológico das aves (Huang et al., 2019).
Diferenças genéticas; Idade e estado fisiológico das aves (Huang et al., 2019).
O Zn tem um amplo impacto nos principais mediadores de imunidade, como enzimas, peptídeos tímicos e citocinas, levando a melhora da resposta do sistema imunológico através da ativação da imunidade celular e humoral (Dardenne, 2002).
Virden et al. (2003) observaram que a suplementação de Zn em dietas de galinhas reforçou o status imune da progênie, inclusive quando desafiadas com Escherichia coli. A capacidade do Zn de participar na indução de substâncias antioxidantes, pode resultar na melhora do sistema de defesa ao eliminar o excesso de radicais livres (Powell, 2000).

Estudos recentes em galinhas poedeiras demonstraram que a suplementação com fontes orgânicas de Zn resultou em maior desempenho na produção de ovos
em comparação com fontes inorgânicas (Idowu et al., 2011; Zhang et al., 2017).
Especialmente para a qualidade da casca do ovo, o uso de suplementação de fonte orgânica aumentou a espessura e resistência da casca em comparação com fontes de Zn inorgânicas.
No entanto, alguns estudos não encontraram diferença na qualidade do ovo ou no desempenho produtivo entre as formas orgânicas e inorgânicas de Zn (Olgun et al., 2017; Tabatabaie et al., 2007).
 O zinco também desempenha um papel na morfologia, fisiologia e funções metabólicas do sistema reprodutor masculino. Geralmente, o Zn não está apenas envolvido na esteroidogênese no sistema de reprodução, mas também influencia indiretamente a secreção do hormônio gonadotrófico através da hipófise (Huang et al., 2019).
O zinco também desempenha um papel na morfologia, fisiologia e funções metabólicas do sistema reprodutor masculino. Geralmente, o Zn não está apenas envolvido na esteroidogênese no sistema de reprodução, mas também influencia indiretamente a secreção do hormônio gonadotrófico através da hipófise (Huang et al., 2019).
Para reprodutores machos, a suplementação de dietas com Zn (50-100 mg/kg) melhorou a qualidade do sêmen com um aumento no espermatócrito (5–7%), volume de ejaculação (0,2–0,3 mL), massa e motilidade espermática individual (cerca de 10%), e levou a diminuição da porcentagem de espermatozoides mortos (7%) e anormais (2–7%) (Amem et al., 2011).
A adição de Zn também é relacionada a proteção da membrana dos espermatozoides contra a peroxidação lipídica, o que aumenta a viabilidade dos espermatozoides  (Gallo et al., 2003). No entanto, altas concentrações de zinco têm efeitos tóxicos na qualidade do esperma em reprodutores machos (Huang et al., 2019).
(Gallo et al., 2003). No entanto, altas concentrações de zinco têm efeitos tóxicos na qualidade do esperma em reprodutores machos (Huang et al., 2019).
O Zn também foi explorado como um suplemento antioxidante para proteger as aves contra o dano oxidativo de estresse por calor (Sahin et al., 2009). Zhu et al. (2017) descobriram que a suplementação de Zn nas dietas maternas, aliviou o efeito negativo do estresse térmico no desempenho de pintos durante o período inicial de vida.
A deficiência de Zn na dieta das aves tem sido associada a várias manifestações clínicas e bioquímicas, e resulta em crescimento atrofiado, perda de apetite e aumento da mortalidade, pintos frequentemente nascem com anormalidades esqueléticas e morrem logo após a eclosão (Naz et al., 2016).
A deficiência de Zn na dieta em pintinhos em crescimento causa redução nas taxas de crescimento, encurtamento e espessamento dos ossos longos e alargamento da articulação do jarrete e desenvolvimento deficiente das penas (Naz et al., 2016).
A necessidade de suplementação dietética de Zn está bem estabelecida e é praticada rotineiramente na indústria de ração para aves. Tradicionalmente, a suplementação de Zn na ração de aves era proveniente de fontes inorgânicas, na forma de sulfato de Zn (ZnSO4) e óxido de Zn (ZnO), por razões de custo e disponibilidade. No entanto, agora há mais formas que são usadas em rações comerciais, que normalmente são queladas em pequenas proteínas e são semelhantes às formas minerais encontradas em matérias-primas naturais (Kidd et al., 1996).

A eficácia do Zn depende de sua absorção no intestino e biodisponibilidade na corrente sanguínea. Foi bem documentado que a forma orgânica do Zn pode ser melhor absorvida em comparação com a forma inorgânica (Sahin et al., 2005). Embora atualmente os avicultores rotineiramente adicionam Zn na dieta das aves acima do nível recomendado pelo NRC (Nutrient Requirements of Poultry, 1994) para evitar a possibilidade de sua deficiência, essa prática tem sido vinculada a poluição ambiental (Burell et al., 2004).
melhor absorvida em comparação com a forma inorgânica (Sahin et al., 2005). Embora atualmente os avicultores rotineiramente adicionam Zn na dieta das aves acima do nível recomendado pelo NRC (Nutrient Requirements of Poultry, 1994) para evitar a possibilidade de sua deficiência, essa prática tem sido vinculada a poluição ambiental (Burell et al., 2004).
Dada a biodisponibilidade aumentada do Zn orgânico, pode ser possível complementar este elemento essencial bem abaixo do nível praticado, resultando em menor excreção de Zn sem o comprometimento do desempenho das aves (Leeson, 2005).

O manganês (Mn) é o quinto mineral mais abundante na terra (Suttle, 2010). Assim como o Zn, o Mn é um mineral essencial para aves, estando envolvido em uma série de atividades, principalmente como constituinte de metaloenzimas.
O Mn é um componente crucial de enzimas que atuam como antioxidantes, estando envolvido no controle do estresse oxidativo nas mitocôndrias e na formação óssea, como a superóxido dismutase, transferases, hidrolases e ligases (Bottje, 2018; Swiatkiewicz et al., 2014). O Mn também tem um papel na ativação da glicosiltransferase, relacionada com a formação de proteoglicanos, sendo, portanto, importante para a formação da casca de ovo (Keen et al., 2013; Liu et al., 1994).
óssea, como a superóxido dismutase, transferases, hidrolases e ligases (Bottje, 2018; Swiatkiewicz et al., 2014). O Mn também tem um papel na ativação da glicosiltransferase, relacionada com a formação de proteoglicanos, sendo, portanto, importante para a formação da casca de ovo (Keen et al., 2013; Liu et al., 1994).
Em aves, a deficiência de Mn está associada a distúrbios fisiológicos e estruturais, que incluem mal formação de cartilagens e do esqueleto.
Por ser essencial para o desenvolvimento da matriz orgânica do osso, em pintos, a deficiência de Mn causa espessamento e a má formação da articulação tíbio metatársica. Em casos de deficiência na dieta de poedeiras ocorre redução na produção de ovos e aumento na incidência de ovos com cascas fracas
(Noetzold et al., 2020).
Relatórios sobre suplementação de Mn foram publicados recentemente com frangos de corte (Pacheco et al., 2017) e galinhas poedeiras (Zhang et al., 2017). Para matrizes pesadas as recomendações para o Mn como suplemento são principalmente baseadas nas sugestões, que variam de 70 a 90 mg Mn/kg de ração (Rostagno et al., 2017) a 120 mg de Mn/kg (Cobb-Vantress, 2018). Essas sugestões, no entanto, carecem de pesquisas in vivo de apoio.


O cobre (Cu) é um micromineral crucial para as aves, e por não ser armazenado no organismo deve ser suplementado regularmente. Além disso, os ingredientes da ração são comumente deficientes em Cu; portanto, a dieta comercial deve ser suplementada com Cu (Scott et al., 2018).
O Cu pode ser incluído na dieta por diferentes fontes, como:
![]() Cloreto de Cu
Cloreto de Cu
![]() Óxido de Cu
Óxido de Cu
![]() Citrato de Cu
Citrato de Cu
![]() Sulfato de Cu
Sulfato de Cu
![]() Cloreto tribásico de Cu
Cloreto tribásico de Cu
No entanto, o sulfato de cobre (CuSO4), por razões econômicas, é a principal fonte de cobre utilizada na avicultura (Pang et al., 2009).
Cu é um elemento-chave necessário para o crescimento e desenvolvimento de ossos, tecido conjuntivo, como colágeno e elastina, coração e vários outros órgãos, além de melhorar o desenvolvimento do sistema nervoso por meio da síntese de dopamina (Mroczek-Sosnowska et al., 2013).
O Cu está envolvido no estimulo do sistema imunológico, no combate a infecções, e na reparação de tecidos lesados (Failla et al., 2003). Também atua no suporte a neutralização de radicais livres que causam lesões celulares (Tapiero et al., 2003). No sistema imune, o Cu é necessário para o desenvolvimento de anticorpos e glóbulos brancos.
O Cu também é importante componente de sistemas enzimáticos envolvidos no metabolismo do ferro e formação de células vermelhas (Scott et al., 2018).
Kim et al. (2011) avaliaram a eficácia potencial de altas doses de Cu orgânico (100ppm, Cu-metionina ou proteinato de Cu) na dieta como substitutos de antibióticos na alimentação de frangos de corte. Os resultados deste experimento mostraram que a suplementação da dieta com ambas as fontes de Cu orgânico melhorou o desempenho dos frangos. A melhora foi comparável àquela resultante da suplementação com antibiótico (avilamicina), outro resultado observado foi o aumento nas populações de lactobacilos e redução da E. coli no intestino. Os autores concluíram que os produtos orgânicos de Cu são potenciais substitutos para os antibióticos.
Deficiência de suplementação de Cu na dieta pode causar distúrbios na reprodução e desenvolvimento espermático, alta mortalidade de embriões, redução na pigmentação das penas, crescimento lento e redução no peso corporal de pintos. Além disso, pode resultar em fraqueza muscular, anemia, alterações ósseas, síntese defeituosa do tecido conjuntivo, mielinização de tecidos nervosos prejudicada e defeitos neurológicos, metabolismo lipídico alterado e mau funcionamento cardíaco (Mroczek-Sosnowska et al., 2013).

 Para consulta da Tabela exclusiva nutriNews Brasil Microminerais 2021, clique aqui
Para consulta da Tabela exclusiva nutriNews Brasil Microminerais 2021, clique aqui
Referências:
Ao T, Pierce J (2013) The replacement of inorganic mineral salts with mineral proteinates in poultry diets. World’s Poult Sci J 69:5–16
Blamberg DL, Blackwood UB, Supplee WC, Combs GF (1960) Effect of zinc deficiency in hens on hatchability and embryonic development. Proc Soc Exp Biol Med 104:217–220
Bottje, W. G. 2018. Oxidative metabolism and efficiency: the delicate balancing act of mitochondria. Poult. Sci. 98:4223–4230.
BURELL, A.L., DOZIER III, W.A., DAVIS, A.J., COMPTON, M.M., FREEMAN, M.E., VENDRELL, P. F. and WARD, T.L. (2004) Responses of broilers to dietary zinc concentrations and sources in relation to environmental implications. British Poultry Science 45: 255-263.
Cobb-Vantress. 2018. Cobb 500 SF Breeder Management Supplement. Cobb-Vantress Inc., Siloam Springs, AR.
Dardenne M (2002) Zinc and immune function. Eur J Clin Nutr 56(Suppl 3):S20–S23
Flinchum JD, Nockels CF, Moreng RE (1989) Aged hens fed zincmethionine had chicks with improved performance. Poult Sci 68(Suppl. 1):55
Gallo R, Veronico M, Nacucchi O, Tafaro E, Barile P, Nicastro F, Zezza L (2003) The effects of selenium, zinc and vitamin E supplementation on performance of broiler breeder males. Ital J Anim Sci 2:471–473
Gao J, Lv ZP, Li CW, Yue YS, Zhao X,Wang FL, Guo YM (2014) Maternal zinc supplementation enhanced skeletal muscle development through increasing protein synthesis and inhibiting protein degradation of their offspring. Biol Trace Elem Res 162(1–3):309–316
Failla ML. Trace elements and host defense: recent advances and continuing challenges. J. Nutr. 2003, 133(5 Suppl 1), 1443S–1447S.
Hassan AM(2018) Effect of in ovo injection with nano-selenium or nano-zinc on post-hatch growth performance and physiological traits of broiler chicks. Int J Agric Biol 3(2):350–357
Huang, Liang, et al. “The role of zinc in poultry breeder and hen nutrition: an update.” Biological trace element research 192.2 (2019): 308-318
Huang YL, Lu L, Li SF, Luo XG, Liu B (2009) Relative bioavailabilities of organic zinc sources with different chelation strengths for broilers fed a conventional corn-soybean meal diet. J Anim Sci 87(6):2038–2046
Huang YL, Lu L, Xie JJ, Li SF, Li XL, Liu SB, Zhang LY, Xi L, Luo XG (2013) Relative bioavailabilities of organic zinc sources with different chelation strengths for broilers fed diets with low or high phytate content. Anim Feed Sci Technol 1.79(1–4):144–148
Hudson BP, DozierWA,Wilson JL (2005) Broiler live performance response to dietary zinc source and the influence of zinc supplementation in broiler breeder diets. Anim Feed Sci Technol 118(3–4):329–335
Hudson BP, Fairchild BD, Wilson JL, Dozier WA, Buhr RJ (2004) Breeder age and zinc source in broiler breeder hen diets on progeny characteristics at hatching. J Appl Poult Res 13(1):55–64
Idowu OMO, Ajuwon RO, Oso AO, Akinloye OA (2011) Effects of zinc supplementation on laying performance, serum chemistry and Zn residue in tibia bone, liver, excreta and egg shell of laying hens. Int J Poult Sci 10:225–230
Iniguez C, Casas J, Carreres J (1978) Effects of zinc deficiency on the chick embryo blastoderm. Acta Anat (Basel) 101(2):120–129
Innocenti A, Zimmerman S, Ferry JG, Scozzafava A, Supuran CT (2004) Carbonic anhydrase inhibitors. Inhibition of the zinc and cobalt gamma-class enzyme from the archaeon Methanosarcina thermophila with anions. Bioorg Med Chem Lett 14(12):3327–3331
KIM, G.B., SEO, Y.M., SHIN, K.S., RHEE, A.R., HAN, J. and PAIK, I.K. (2011) Effects of supplemental copper-methionine chelate and copper-soy proteinate on the performance, blood parameters, liver mineral content, and intestinal microflora of broiler chickens. The Journal of Applied Poultry Research 20: 21-32.
Keen, C. L., J. L. Ensunsa, B. L€onnerdal, and S. Zidenberg-Cherr. 2013. Manganese. In Encyclopedia of Human Nutrition. B. Caballero, L. Allen, and A. Prentice, eds. 3rd ed. Elsevier Ltd., Oxford, UK.
KiddMT, Anthony NB, Lee SR (1992) Progeny performance when dams and chicks are fed supplemental zinc. Poult Sci 71(7):1201–1206
Kidd MT, Anthony NB, Newberry LA, Lee SR (1993) Effect of supplemental zinc in either a corn-soybean or a milo and cornsoybean meal diet on the performance of young broiler breeders and their progeny. Poult Sci 72(8):1492–1499
KIDD, M.T., FERKET, P.R. and QURESHI, M.A. (1996) Zinc metabolism with special reference to its role in immunity. World’s Poultry Science Journal 52: 309-323.
Kim JW, Kim JH, Shin JE, Kil DY. Relative bioavailability of copper in tribasic copper chloride to copper in copper sulfate for laying hens based on egg yolk and feather copper concentrations. Poult. Sci. 2016, 95, 1591–1597.
LEESON, S. (2005) Trace mineral requirements of poultry – Validity of the NRC recommendations, in: TAYLOR-PICKARD, J.A. & TUCKER, L.A. (Eds) Redefining Mineral Nutrition, pp. 107-117 (Nottingham University Press, Nottingham, UK).
Liu, A. C.-H., B. S. Heinrichs, and R.M. Leach, JR. 1994. Influence of manganese on the characteristics of proteoglycans of avian epiphyseal growth plate cartilage. Poult. Sci. 73:663–669.
Mroczek-Sosnowska N, Batorska M, Lukasiewicz M, Wnuk A, Sawosz E, Jaworski S, Niemiec J. Effect of nanoparticles of copper and copper sulfate administered in ovo on hematological and biochemical blood markers of broiler chickens. Annals of Warsaw University of Life Sciences-SGGW. Anim. Sci. 2013, 52, 141–149.
NAZ, S. et al. The activity and use of zinc in poultry diets. World’s Poultry Science Journal, v. 72, n. 1, p. 159-167, 2016.
NOETZOLD, T. L. et al. Manganese requirements of broiler breeder hens. Poultry Science, v. 99, n. 11, p. 5814-5826, 2020.
NRC (1994) Nutrient Requirements of Poultry. 9th rev. ed. National Academy Press, Washington, DC. USA
Olgun O, Yildiz AO (2017) Effects of dietary supplementation of inorganic, organic or nano zinc forms on performance, eggshell quality, and bone characteristics in laying hens. Ann Anim Sci 17(2):463–476
Pacheco, B. H. C., V. S. Nakagi, E. H. Kobashigawa, A. R. M. Caniatto, D. E. Faria, and D. E. Faria Filho. 2017. Dietary levels of zinc and manganese on the performance of broil-ers between 1 to 42 days of age. Braz. J. Poult. Sci. 19:171–178.
Pang Y, Patterson JA, Applegate TJ. The influence of copper concentration and source on ileal microbiota. Poul. Sci. 2009, 88, 586–592.
Powell SR (2000) The antioxidant properties of zinc. J Nutr 130(5):1447s–1454s
Richards MP (1997) Trace mineral metabolism in the avian embryo. Poult Sci 76(1):152–164
Rostagno, H. S., L. F. T. Albino, M. I. Hannas, J. L. Donzele, N. K. Sakomura, F. G. Perazzo, A. Saraiva, M. L. Teixeira, P. B. Rodrigues, R. F. Oliveira, S. L. T. Barreto, and C. O. Brito. 2017. Brazilian Tables for Poultry and Swine: Composition of Foods and Nutritional Requirements. 4th ed. UFV, Viçosa, Minas Gerais, Brazil.
Sahin K, Sahin N, Kucuk O, Hayirli A, Prasad AS (2009) Role of dietary zinc in heat-stressed poultry: a review. Poult Sci 88(10):2176–2183
SAHIN, K., SMITH, M.O., ONDERCI, M., SAHIN, N., GURSU, M.F. and KUCUK, O. (2005) Supplementation of zinc from organic or inorganic source improves performance and antioxidant status of heat-distressed quail. Poultry Science 84: 882-887.
SCOTT, Abdullah et al. Copper nanoparticles as an alternative feed additive in poultry diet: a review. Nanotechnology Reviews, v. 7, n. 1, p. 69-93, 2018.
Spears, J. W., and T. E. Engle. 2011. Feed Ingredients: Feed Supplements: Microminerals. Pages 378–383 in Encyclopedia of Dairy Sciences. Elsevier, Amsterdam, Netherlands.
Sun X, Lu L, Liao X, Zhang L, Lin X, Luo X, Ma Q (2018) Effect of in Ovo zinc injection on the embryonic development and epigenetics-related indices of zinc-deprived broiler breeder eggs. Biol Trace Elem Res 185(2):456–464
Suttle, N. F. 2010. The Mineral Nutrition of Livestock. 4th ed. CABI Publishing, Oxford Shire, UK.
ŚWIĄTKIEWICZ, S.; ARCZEWSKA-WŁOSEK, A.; JOZEFIAK, D. The efficacy of organic minerals in poultry nutrition: review and implications of recent studies. World’s Poultry Science Journal, v. 70, n. 3, p. 475-486, 2014.
TabatabaieMM, Aliarabi H, Saki AA, Ahmadi A, Siyar SA (2007) Effect of different sources and levels of zinc on egg quality and laying hen performance. Pak J Biol Sci 10(19):3476–3478
Tapiero H, Townsend DM, Tew KD. Trace elements in the human physiology and pathology. Copper. Biomed. Pharmacother. 2003, 57, 386–398.
Virden WS, Yeatman JB, Barber SJ, Zumwalt CD, Ward TL, Johnson AB, Kidd MT (2003) Hen mineral nutrition impacts progeny livability. J Appl Poult Res 12(4):411–416
Zhang YN, Zhang HJ, Wang J, Yue HY, Qi XL, Wu SG, Qi GH (2017) Effect of dietary supplementation of organic or inorganic zinc on carbonic anhydrase activity in eggshell formation and quality of aged laying hens. Poult Sci 96(7):2176–2183
Zhu YW, LiWX, Lu L, Zhang LY, Ji C, Lin X, Liu HC, Odle J, Luo XG (2017) Impact of maternal heat stress in conjunction with dietary zinc supplementation on hatchability, embryonic development, and growth performance in offspring broilers. Poult Sci 96(7):2351–2359
[/registrados]
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar esta publicação e muito mais conteúdo especializado. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em nutriNews
REGISTRE-SE













