Revisamos esta semana este artículo porque como estamos últimamente recordando las micotoxinas SIEMPRE se deben controlar y prevenir…
Las micotoxinas son sustancias tóxicas producidas por hongos micotoxigénicos en productos agrícolas, principalmente cereales, y cuya ingestión, inhalación o absorción cutánea produce efectos adversos sobre la salud del hombre y de animales, afectando al hígado, riñón, sistema nervioso, endocrino e inmunitario.
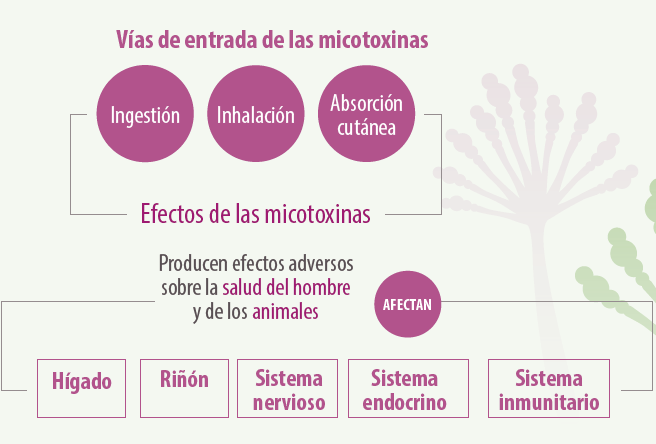
Las micotoxinas más importantes desde el punto de vista de la seguridad alimentaria son las aflatoxinas, ocratoxina A, zearalenona, fumonisinas, y tricotecenos.
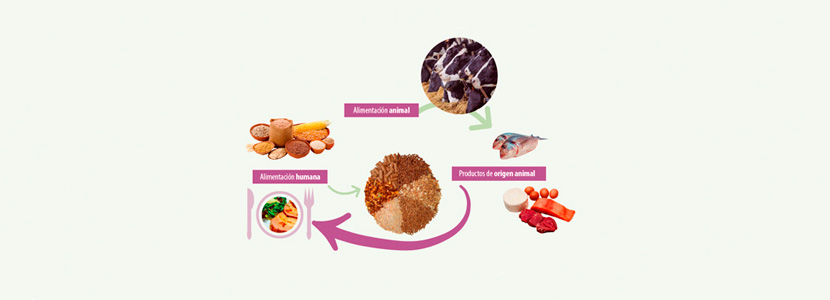
Hoy en día, uno de los problemas de gran interés es la presencia de micotoxinas en piensos, ya que éstas pueden transferirse a tejidos y productos derivados (carne, leche, huevos) de los animales alimentados con piensos contaminados (figura 1).
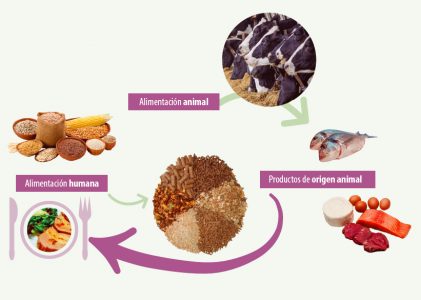
Figura 1. Exposición a micotoxinas a través de la ingesta en humanos y animales (Tolosa, 2017).
Los cereales constituyen la materia prima principal en la formulación de los piensos, (Santos et al., 2011), por lo que las micotoxinas se han convertido en uno de los grandes retos del sector ganadero, afectando también a otros eslabones de la cadena, como almacenistas, fabricantes y ganaderos.
La obligación de aplicar los límites reglamentarios establecidos ha impulsado el desarrollo de técnicas analíticas para el análisis de micotoxinas en alimentos y piensos que cumplan con los sistemas de control y requerimientos de calidad establecidos. Estas técnicas se clasifican en dos grandes grupos:
(1) métodos rápidos de detección de micotoxinas
(2) métodos instrumentales
MÉTODOS RÁPIDOS DE DETECCIÓN
Entre los métodos rápidos se incluyen aquellos métodos cualitativos o semicuantitativos que permiten un análisis rápido, económico, con bajo componente instrumental y sencillo de manejar, empleados principalmente para realizar un screening de un gran número de muestras (González-Sapienza & Venancio, 2011).
La mayoría de los métodos rápidos son ensayos inmunoquímicos basados en el empleo de anticuerpos como elementos de reconocimiento específico de la micotoxina diana, utilizados comúnmente como análisis de rutina en las fábricas de pienso.
Métodos inmunoquímicos
El principio de funcionamiento de estos métodos es la reacción antígeno-anticuerpo, siendo el antígeno una micotoxina modificada, que una vez producida se convierte en una señal que permite la cuantificación de ésta.
- Inmunoensayos
- La técnica más empleada es el Ensayo de Inmunoabsorción Ligado a Enzimas (ELISA) competitivo directo (figura 2), comercializada en forma de kits compuestos de microplacas cubiertas con el anticuerpo de la micotoxina, reactivos y estándares necesarios para realizar el análisis.
- Esta técnica se basa en la capacidad de un anticuerpo específico para distinguir la estructura tridimensional de una micotoxina determinada. La técnica requiere de una extracción sencilla de la muestra con un disolvente.
- Tras el desarrollo del kit, se genera una reacción colorimétrica inversamente proporcional a la concentración de micotoxina en la muestra, medida por el lector de ELISA a una absorbancia de 450 nm.
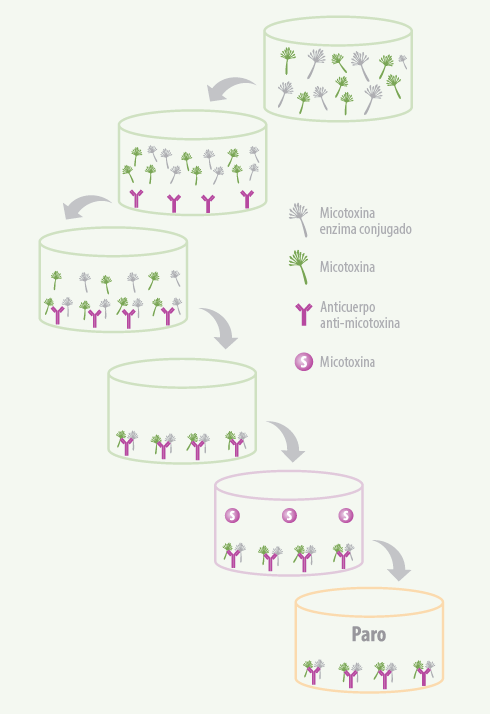 Figura 2. Esquema del análisis de micotoxinas mediante ELISA competitivo (Ortiz et al., 2014).
Figura 2. Esquema del análisis de micotoxinas mediante ELISA competitivo (Ortiz et al., 2014).
La principal ventaja es que permiten una importante simplificación de la etapa de preparación de las muestras, ya que requieren pequeños volúmenes de muestra y procedimientos de purificación más sencillos.
El método es rápido, simple, específico y cuantitativo.
La principal desventaja es la aparición de reacciones cruzadas con micotoxinas del mismo grupo o las interferencias con la matriz.
- Inmunoensayos basados en membranas: Ensayo Flow-through/Lateral flow test
Se trata de un ELISA competitivo directo que consiste en tiras compuestas de un bloque donde se coloca la muestra, otro donde está el conjugado, una membrana, un bloque adsorbente y una base adhesiva, en la que el anticuerpo anti-micotoxina se une a la superficie de una membrana (figura 3).
Es un método semicuantitativo, muy sencillo, rápido y estable, siendo una técnica muy útil para tomar decisiones a pie de campo o de fábrica.
El principal inconveniente de los métodos inmunoquímicos reside en que legalmente los positivos han de confirmarse por técnicas con mayor selectividad, como la espectrometría de masas (EM).
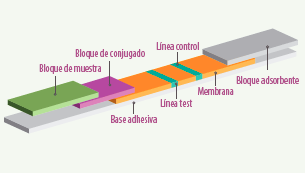
Figura 3. Ensayo Flow-through.
- Extracción mediante columnas de inmunoafinidad
Las columnas de inmunoafinidad han sido comúnmente empleadas por su facilidad de uso y su alta selectividad.
El procedimiento consiste en el acondicionamiento previo de las columnas, seguido de la adición del extracto a analizar. La micotoxina se une específicamente a los anticuerpos monoclonales presentes en la columna, mientras que el resto de compuestos son eliminados mediante adición de un líquido de lavado.
Tras este lavado, las micotoxinas se eluyen mediante la adición de un disolvente que provoca la desnaturalización de los anticuerpos (figura 4) (Soriano et al., 2007).
Como ventajas destacan la elevada especificidad, requiere extractos iniciales poco limpios y ofrece altas recuperaciones y pureza de los extractos. Sin embargo, no son reutilizables y presentan un coste relativamente elevado.
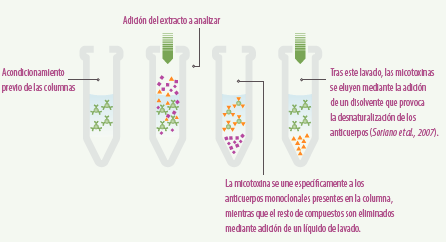
Figura 4. Esquema de empleo de columnas de inmunoafinidad.
Aunque el método de columnas de inmunoafinidad fue originalmente desarrollado para la cuantificación mediante fluorometría, en la actualidad las columnas han sido utilizadas para la purificación y concentración de las micotoxinas para su detección posterior mediante cromatografía líquida y/o gaseosa.
METODOS INSTRUMENTALES
Técnicas cromatográficas
La cromatografía líquida de alta resolución (HPLC) constituye la técnica de elección para el análisis de micotoxinas, o para confirmación de resultados positivos por ELISA, ya que son sensibles, reproducibles, exactos y presentan un mayor grado de automatización.
Las técnicas espectrométricas de absorción y emisión más empleadas son la detección ultravioleta (UV) y la fluorescencia (FL), siendo preferible esta última cuando las micotoxinas presentan fluorescencia natural.
No obstante, el acoplamiento de HPLC a detectores de MS ha permitido el desarrollo de nuevas metodologías para la detección y cuantificación de micotoxinas y el establecimiento de métodos multirresiduo, que abarcan micotoxinas de diferentes familias, convirtiéndose en uno de los métodos de elección para llevar a cabo análisis multi-micotoxina (Tolosa, 2017).
Todo esto, unido a los bajos límites de cuantificación y sobre todo al hecho de que permite confirmar la presencia de micotoxinas de forma inequívoca está haciendo que esta técnica se esté considerando cada vez más como la mejor opción para el análisis de micotoxinas.
Por lo que respecta a la cromatografía de gases (GC), su empleo es menos común debido a que la mayoría de las micotoxinas no son suficientemente volátiles y, por lo tanto, tienen que ser derivatizadas, incrementando el tiempo de análisis.
El principal grupo de micotoxinas analizadas mediante GC son los tricotecenos, obteniéndose límites de detección y coeficientes de variación adecuados previa reacción de silanización (Rodríguez-Carrasco et al., 2012; Escrivá et al., 2016).
El empleo de las técnicas cromatográficas requiere de una preparación previa de la muestra, empleándose diferentes métodos de extracción y purificación dependiendo de las micotoxinas a analizar y de la matriz alimentaria, como por ejemplo las columnas de inmunoafinidad u otros procedimientos basados en la extracción sólido-líquido (Quechers, DMFS, etc.) o líquido-líquido (DLLME).
El coste del equipo y de su mantenimiento es elevado y se requiere de un alto grado de preparación del analista, por lo que estas técnicas no son empleadas como primera opción a nivel de campo o fábrica cuando se requieren resultados rápidos, sino más bien como técnicas de confirmación y/o cuantificación.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en nutriNews
REGISTRARME