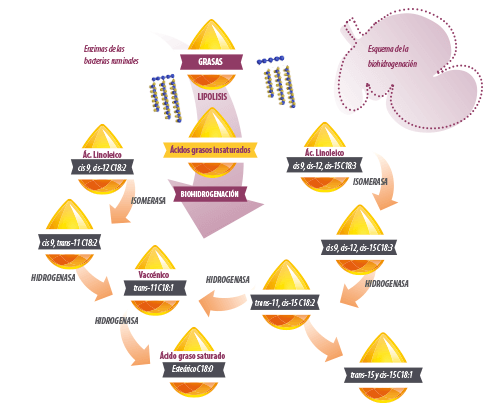
En este trabajo, analizaremos los resultados que han obtenido los investigadores en los ensayos in vivo y detallaremos con más detenimiento la biohidrogenación de las grasas en el rumen, proceso que como ya vimos es el paso posterior a la lipolisis, primer proceso al que se ven sometidas las grasas que entran al rumen.
Adaptación detoxificante – biohidrogenación
Este proceso se considera como una adaptación detoxificante (Kemp et al., 1984), y contribuye marginalmente a la eliminación de los equivalentes reductores producidos por la fermentación ruminal (Lourenço, et al. 2010).
La biohidrogenación (BH) comprende varios pasos, dependiendo de los AGI, y varias vías, dependiendo de la dieta y el ambiente ruminal (Griinari et al., 1998).
Los protozoos engloban bacterias, y la biohidrogenación bacteriana puede tener lugar dentro de los protozoos (Jenkins et al., 2008) y explicar sus altas concentraciones de productos intermediarios (Devillard et al., 2006).
Estudios in vivo
Más allá de los estudios basados en los aislamientos seleccionados, se han realizado intentos para evaluar in vivo la relación entre bacterias del rumen y la biohidrogenación agregando bacterias y midiendo sus productos, o agregando suplementos dietéticos que se sabe que afectan a la BH y medir la abundancia de bacterias.
Por regla general
Los estudios in vivo de adición de grasa han demostrado que no hay cambios o disminución en los géneros de protozoos totales y principales.
Otras observaciones ….
Hristov et al., 2012 observaron que el ácido láurico (C12: 0) disminuyó fuertemente los recuentos de protozoos en comparación con los ácidos mirístico (C14: 0) y esteárico (C18: 0).
Oldick y Firkins (2000), de manera más general, mostraron que al aumentar el grado de insaturación disminuye el recuento de protozoos, pero enfatizaron que este cambio puede ser difícil de evaluar debido a la variación individual, lo que explica la inconsistencia en los ensayos.
Observaciones sobre la comunidad archeal
Los estudios con cepas puras de arqueas añadiendo ácidos orgánicos o ácidos grasos saturados mostraron una inhibición de la producción de metano por Methanobrevibacter ruminantium.

Lillis et al. (2011) demostraron que la adición de aceite de soja in vivo alteró el recuento pero no la diversidad de las archeas metanogénicas, y plantearon la hipótesis de que estos cambios podrían ser consecuencia de la alteración del perfil de AGV (menos acetato y butirato que producen H2, y más propiónico), debido a cambios en la comunidad bacteriana.
Hristov et al. (2012) plantearon que los cambios en la comunidad archaeal podrían ser una consecuencia de la disminución de la abundancia de protozoos con dietas ricas en grasa.
Sobre el ácido linoléico…
En cultivos puros, el ácido linoleico (AL) puede afectar el crecimiento del hongo Neocallimastix frontalis (Maia et al., 2007).
Boots et al. (2012) confirmaron in vivo el efecto negativo de la adición de AL en el orden Neocallimastigales, cuya riqueza y diversidad disminuyen por la adición de aceite de soja.
El efecto inhibitorio de los aceites sobre el crecimiento bacteriano se ha estudiado extensamente en cultivos puros in vitro de cepas de rumen (Maia et al., 2007), centrándose en bacterias que desempeñan un papel en la fibrólisis, amilólisis y metabolismo de las grasas.
En conjunto, estos primeros estudios sobre AG saturados y monoinsaturados enfatizaron que los efectos de las grasas sobre las bacterias del rumen dependen del metabolismo bacteriano, la insaturación de los AG y la configuración geométrica de dobles enlaces.
Los efectos negativos de AG sobre B. fibrisolvens son:
+ fuertes para ALA que para AL
++ fuertes para AG de cadena larga eicosapentaenoico (EPA; cis-5, cis-8, cis-11, cis-14, cis-17-C20: 5 ) y los ácidos docosahexaenoico (DHA; cis-4, cis-7, cis-10, cis-13, cis-16, cis-19-C22: 6).
De forma similar, ALA aumenta fuertemente la fase de latencia y disminuye la tasa de crecimiento de Propionibacterium acnesn (Maia et al., 2016).
Efectos sobre las bacterias in vivo
Los efectos de los suplementos de grasa se investigaron in vivo, asignando bacterias a nivel de especie utilizando PCR cuantitativa (Martin et al., 2016; Vargas-Bello-Perez, et al., 2016) o, a nivel de género, utilizando 16S rDNA pirosecuenciación (Zened et al., 2013a; Huws et al., 2014).
En estos últimos se encontraron efectos significativos de la grasa en bacterias aún no cultivadas o no clasificadas.

Estos experimentos se basaron principalmente en la adición de aceite, a diferencia de la mayoría de los estudios sobre cultivos de cepa pura que utilizaron AG libres.
En conjunto, los efectos fueron menores que los observados con cultivos puros, lo que podría deberse al tipo de grasa añadida o al hecho de que los efectos en la fase de latencia no se pueden ver in vivo.
Los cambios en la microbiota ruminal debido a una mayor proporción de concentrado son mucho más altos que los efectos debidos a la adición de grasas, y algunos géneros se vieron afectados de manera diferente por la adición de aceite en dietas de bajo y alto concentrado, especialmente Acetitomaculum, Lachnospira y Prevotella (Zened et al. 2011).
Entre los géneros de bacterias o especies que se estudiaron en varios experimentos, Fibrobacter y Ruminococcus se vieron afectados negativamente en la mayoría de los casos, pero los efectos en Butyrivibio y Prevotella fueron muy variables.
Estos últimos géneros comprenden muchas especies con funciones algo diferentes, distintas vías metabólicas y diferentes sensibilidades a AG en cultivos (Maia et al., 2007).
Una disminución de la abundancia in vivo de un género bacteriano después de un cambio en la dieta, no se puede interpretar inequívocamente como un efecto directo de una dieta, pero podría reflejar un cambio más global en la degradación de nutrientes y en las relaciones entre los diferentes microorganismos del rumen.
¿Cómo inhiben los AG el crecimiento bacteriano?
Existen varias hipótesis para explicar el mecanismo inhibidor de los AG en el crecimiento bacteriano:
Hipótesis nº 1 . La mayoría de los lípidos están asociados con partículas de la dieta en el rumen, y el recubrimiento de las partículas de la dieta podría perjudicar la adhesión, disminuyendo la degradación de la fibra en el rumen (Devendra y Lewis 1974). Sin embargo, esta hipótesis no es consistente con el aumento en el número de bacterias que se adhieren a las partículas en la fase sólida del rumen cuando se agrega grasa a la dieta (Bauchart et al., 1986).
Hipótesis nº2 . Devendra y Lewis (1974) también propusieron que la grasa de la dieta podría disminuir la disponibilidad de cationes a las bacterias, debido a la formación de sales, lo cual es consistente con los efectos protectores de las sustancias ricas en calcio sobre la degradación de la celulosa cuando se agrega aceite a la dieta (Brooks et al., 1954). Sin embargo, no puede explicar todos los efectos negativos de la grasa en la dieta.
Hipótesis nº3 . Devendra y Lewis (1974) también plantearon la hipótesis de que AG podría ejercer una toxicidad directa sobre las bacterias del rumen, lo que es consistente con la incorporación de AGI en los cultivos bacterinos (Bauchart et al. al. 1990). Esta toxicidad podría deberse a un impedimento en el paso de nutrientes debido a que los AG se adhieren a la pared celular.
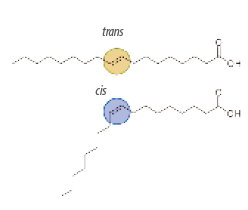
Un efecto específico de los dobles enlaces cis podrían explicar por qué la mayoría de las bacterias bioiniciadoras conocidas, producen trans-C18:1, pero no lo reducen más a ácido esteárico.
El ácido linoleico puede alterar la integridad celular, pero no existe una relación entre esta alteración y el nivel de inhibición del crecimiento bacteriano en diferentes cepas en el rumen, incluida
B. fibrisolvens.
Conclusión y perspectivas
La relación entre los lípidos de la dieta y la microbiota del rumen está dominada por la toxicidad de los AGI en muchos microorganismos, especialmente las bacterias fibrolíticas.
Se sabe que el género Butyrivibrio está fuertemente involucrado en el proceso de detoxificación.
Muchos estudios recientes sugieren que las vías bioquímicas son más complejas y que las bacterias involucradas podrían ser más diversas de lo que se creía hace varias décadas.
Las aplicaciones prácticas involucran ambos lados de esta relación.
La adición de grasa a la dieta da forma a la comunidad microbiana del rumen, modula la función del rumen y esto ha hecho que una gran cantidad de investigación en los últimos años se haya dedicado a la reducción de las emisiones de metano, aunque el modo de acción no se comprende completamente y podría depender de la fuente de grasa (Patra y Yu 2013).
Existen efectos colaterales negativos en la eficiencia alimenticia, como la reducción de consumo de materia seca (Beauchemin et al., 2009).

Las opciones más adecuadas para dar forma a la microbiota del rumen y su actividad dependen de muchos factores:
- Sistema de producción
- Condiciones económicas
- Regulaciones locales o especificaciones
Sin embargo, para aplicar estas diferentes manipulaciones en el campo, se deben obtener nuevos datos in vivo en diversas condiciones dietéticas con estudios a largo plazo porque la resiliencia de la microbiota ruminal o su adaptación a la degradación de compuestos de plantas puede alterar los efectos durante tiempo (Weimer 2015).
Además, dirigir nuevas investigaciones aplicadas sobre el metabolismo ruminal de las grasas hace necesario conocer mejor qué microorganismos, qué mecanismos enzimáticos y qué interacciones entre los microorganismos y entre la microbiota y el huésped están involucrados.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en nutriNews
REGISTRARME