Efectos del estrés crónico y la inflamación intestinal en la salud y el rendimiento de las aves de corral: Revisión
INTRODUCCIÓN
| Los pollos de engorde modernos son, sin duda, la manifestación más visible de los avances genéticos que, acompañados de la alimentación, las medidas sanitarias y las prácticas de manejo intensivo, han dado lugar al éxito de esta producción. Sin embargo, para alcanzar estos objetivos, es necesario mantener el tracto gastrointestinal (TGI) en buen estado. |
| El TGI es el órgano responsable de la digestión y absorción de nutrientes. El costo de la coccidiosis subclínica o la enteritis necrótica en los pollos de engorde es, probablemente, mayor que el de las infecciones agudas clínicamente identificadas en aves de corral, dado que la conversión alimenticia representa más del 70% del costo total de producción (Aggrey et al., 2010). |
A medida que se acorta el período de crecimiento de los pollos de engorde y mejora la eficiencia alimenticia, la necesidad de programas mejorados de salud y nutrición se vuelve más evidente.
![]() Debido a que los cambios durante el desarrollo intestinal son pequeños, a menudo se pasan por alto, por lo que, la salud intestinal impacta en la salud general y la productividad.
Debido a que los cambios durante el desarrollo intestinal son pequeños, a menudo se pasan por alto, por lo que, la salud intestinal impacta en la salud general y la productividad.
La sustitución de antibióticos en los sistemas de producción por productos alternativos, mejores prácticas de manejo, estricta bioseguridad, ingredientes de calidad, ausencia de enfermedades (Mycoplasma/Salmonella) y programas efectivos de inmunización son estrategias eficaces para alcanzar los objetivos de salud y productividad.
| En este trabajo, nos centramos en revisar las repercusiones significativas del estrés crónico y la inflamación intestinal en la salud y el rendimiento de las aves comerciales. |
INTERACCIÓN MICROBIOTA-CEREBRO-INTESTINO
![]() Además de digerir alimentos y absorber agua y nutrientes, el tracto intestinal contiene una comunidad microbiana diversa y compleja (Celluzzi & Masotti, 2016), así como un sistema nervioso entérico (SNE) que es considerado el “segundo cerebro” del organismo (Schneider et al., 2019).
Además de digerir alimentos y absorber agua y nutrientes, el tracto intestinal contiene una comunidad microbiana diversa y compleja (Celluzzi & Masotti, 2016), así como un sistema nervioso entérico (SNE) que es considerado el “segundo cerebro” del organismo (Schneider et al., 2019).
Esta población microbiana puede igualar en número a las células somáticas encontradas en este tejido (Wallis et al., 2004; Zhu et al., 2010; Li et al., 2014; Sender et al., 2016).
| Aparte de la complejidad en la estructura y las relaciones microbianas, en los pollos, el tejido linfoide asociado al intestino (GALT, por sus siglas en inglés) contiene la mayor concentración de células inmunitarias en el organismo, lo que demuestra su gran importancia (Peralta et al., 2017; Casteleyn et al., 2010). |
Asimismo, el aparato digestivo tiene órganos linfoides primarios como la bolsa de Fabricio, donde se originan y multiplican los linfocitos B; este componente del GALT, en las especies aviares, es esencial para proteger al tracto digestivo (Bar-Shira et al., 2003).
| El microbioma intestinal puede influir en la biología, nutrición, inmunidad y sistema neuroendocrino del huésped (Dimitrov, 2011). |
| La función del TGI parece estar mediada por ácidos grasos de cadena corta (AGCC) generados por la fermentación bacteriana (Wu et al., 2017), la comunicación entre la microbiota y las neuronas (Megur et al., 2020), el sistema endocrino (Fukui et al., 2018), el sistema inmunológico (Maslowski & Mackay, 2011) y la modulación de la barrera epitelial intestinal (Sharma et al., 2010). El SNE y la red endocrina intestinal controlan la motilidad del TGI y su disrupción genera trastornos funcionales en el mismo (Fukui et al., 2018). |
![]() La serotonina tiene múltiples funciones biológicas relacionadas con la psicología y las actividades fisiológicas en procariotas y eucariotas, como la regurgitación, la vasodilatación, la motilidad del TGI, la cicatrización de heridas, la reproducción y la vasoconstricción, entre otras (Negri et al., 2021; Berger et al., 2009).
La serotonina tiene múltiples funciones biológicas relacionadas con la psicología y las actividades fisiológicas en procariotas y eucariotas, como la regurgitación, la vasodilatación, la motilidad del TGI, la cicatrización de heridas, la reproducción y la vasoconstricción, entre otras (Negri et al., 2021; Berger et al., 2009).
| A su vez, la microbiota intestinal controla parcialmente la secreción de serotonina, dopamina, oxitocina y endorfinas producidas por las células enteroendocrinas (CEE) que se encuentran en el epitelio del TGI (Forsythe et al., 2010; Liang et al., 2014; Mayer et al., 2014). |
| La compleja red neuroendocrina que conecta el cerebro, el SNE, la microbiota intestinal y el GALT (eje microbiota-cerebro-intestino) tiene un impacto sustancial en la frágil barrera epitelial del intestino (Neuman et al., 2015; Megur et al., 2020), que también mantiene la tolerancia y la respuesta inmune contra antígenos extraños y el equilibrio de la microbiota (Maslowski & Mackay, 2011). |
| Por lo tanto, el estrés prolongado y la inflamación impactan negativamente en el eje microbiota-cerebro-intestino, causando disbiosis y alterando las proteínas de unión estrecha con la translocación sistémica de bacterias y otros antígenos (Figura 1). |
![]() Durante el estrés crónico y, como resultado, la inflamación intestinal crónica, la energía para crecimiento y reproducción se desvía para sostener la respuesta inflamatoria, y las aves no son una excepción a esta regla.
Durante el estrés crónico y, como resultado, la inflamación intestinal crónica, la energía para crecimiento y reproducción se desvía para sostener la respuesta inflamatoria, y las aves no son una excepción a esta regla.
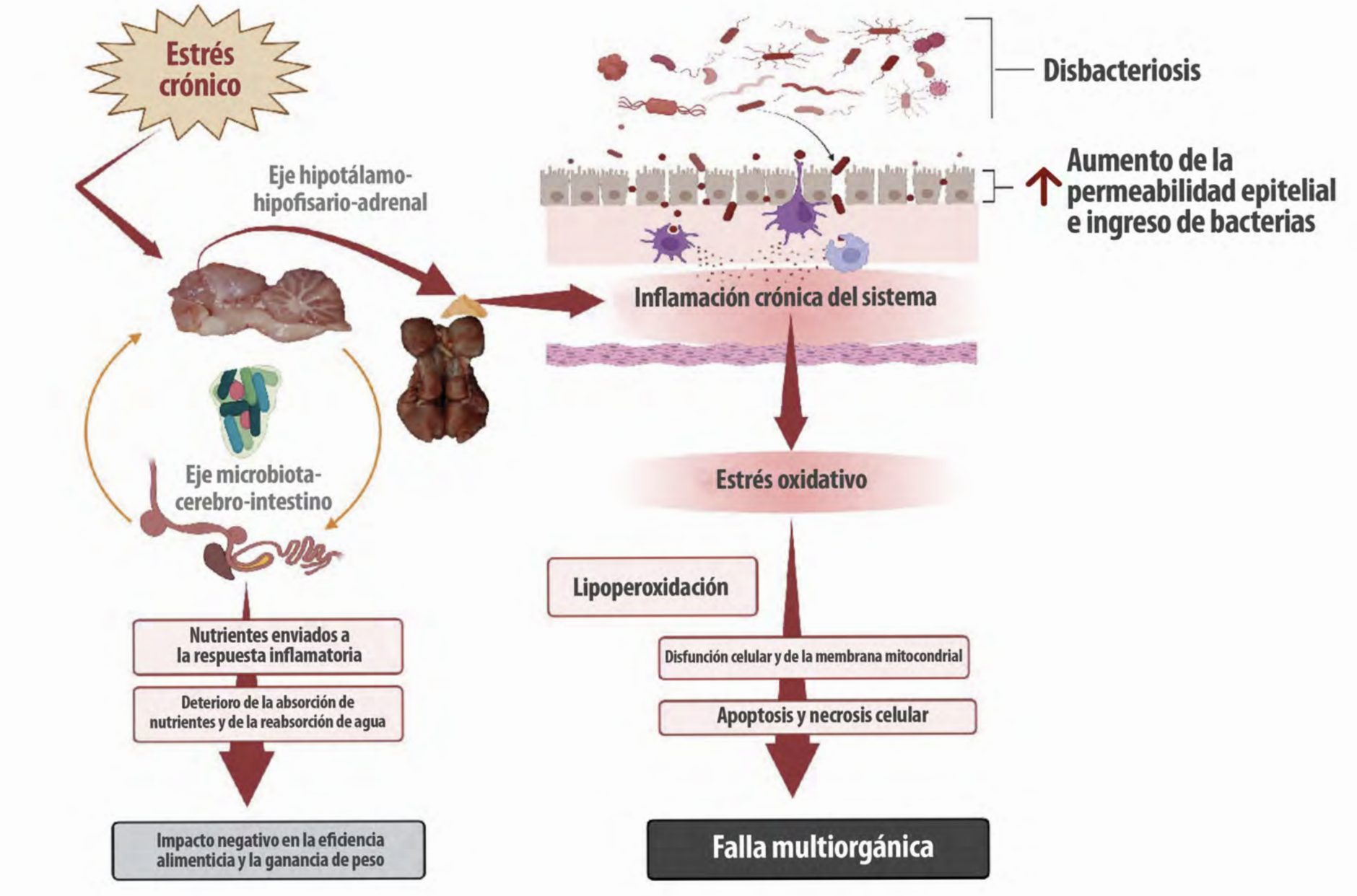
Figura 1. Impacto del estrés crónico: Patogénesis y consecuencias.
El estrés crónico (independientemente de su origen) tiene un impacto directo en el eje hipotálamo-hipofisario-adrenal (eje HPA), el eje microbiota-cerebro-intestino (eje MCI) y los sistemas endocrino e inmunológico. Las inflamaciones intestinales y sistémicas crónicas se originan a partir de alteraciones en el delicado equilibrio y entorno de la microbiota intestinal (disbacteriosis) y alteraciones en las proteínas de unión estrecha entre los enterocitos, que causan permeabilidad intestinal. El estrés oxidativo prolongado inducido por el proceso inflamatorio causa peroxidación de fosfolípidos en las membranas celulares y mitocondriales, lo que conduce a apoptosis, necrosis celular y falla multiorgánica (creada con BioRender.com).
INFLAMACIÓN INTESTINAL
Por otra parte, las infecciones bacterianas del TGI, debido a su presencia y mecanismo de colonización, son inductoras de procesos inflamatorios agudos o incluso crónicos (Yamamoto et al., 2013).
![]() En modelos murinos, el crecimiento de Salmonella es ayudado, irónicamente, por respuestas inflamatorias agudas a bacterias patógenas en el intestino, ya que se produce una mayor migración de neutrófilos y producción de especies reactivas de oxígeno (ROS, por sus siglas en inglés) y especies reactivas de nitrógeno (RNS, por sus siglas en inglés) como resultado de la infección por Salmonella, lo que interrumpe el equilibrio de la microbiota (Winter et al., 2010a).
En modelos murinos, el crecimiento de Salmonella es ayudado, irónicamente, por respuestas inflamatorias agudas a bacterias patógenas en el intestino, ya que se produce una mayor migración de neutrófilos y producción de especies reactivas de oxígeno (ROS, por sus siglas en inglés) y especies reactivas de nitrógeno (RNS, por sus siglas en inglés) como resultado de la infección por Salmonella, lo que interrumpe el equilibrio de la microbiota (Winter et al., 2010a).
Un aumento del oxígeno molecular en el lumen intestinal deprime importantes anaerobios comensales como Bacteroidetes y Clostridiales, que son bacterias esenciales productoras de ácido butírico (Rigottier-Gois, 2013). La oxidación de tiosulfato a tetrationato es también un subproducto de las ROS (Winter et al., 2010b).
| En modelos murinos, se ha demostrado que Salmonella utiliza tetrationato para fortalecer su desarrollo (Winter et al., 2010b); de ahí, el uso de caldo de tetrationato como medio enriquecido para el cultivo de Salmonella en laboratorios de diagnóstico. |
| Generalmente, los agentes infecciosos (bacterianos, protozoarios, virales, helmintos) estimulan respuestas proinflamatorias del huésped. Por ejemplo, en aves domésticas, la coccidiosis puede causar necrosis e inflamación en el intestino, resultando en fiebre, depresión, reducción del rendimiento y muerte, dependiendo de la especie de Eimeria y la dosis infectante (Rose et al., 1975) (Figura 2). |
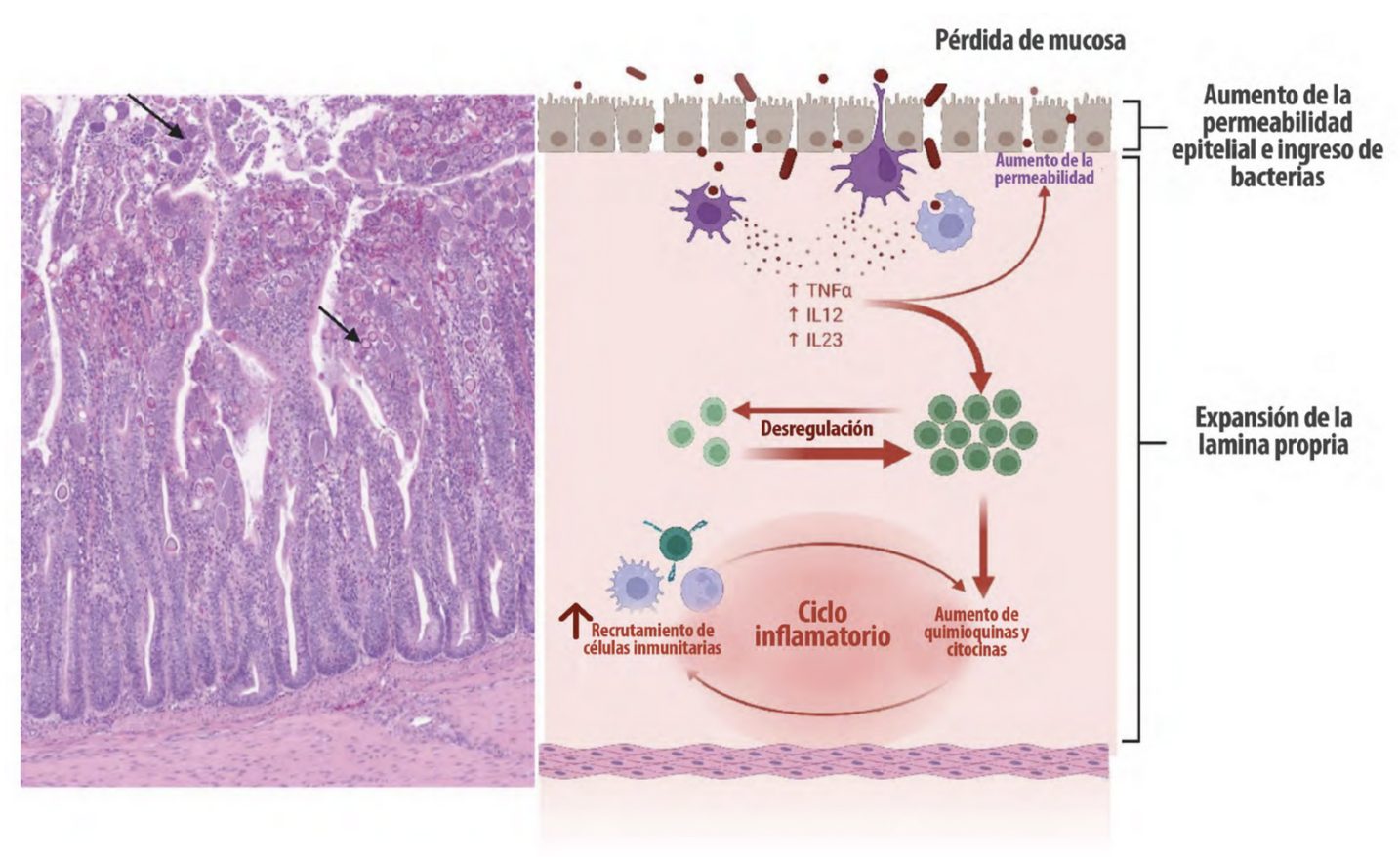
Figura 2. Falla de la barrera intestinal.
Los agentes infecciosos (bacterianos, protozoarios, virales, helmintos) en aves de corral estimulan las respuestas proinflamatorias del huésped. Falla de la barrera intestinal causada por Eimeria tenella. Mucosa y submucosa de los ciegos con infiltración de células inflamatorias, ulceración y necrosis. Las flechas muestran la presencia del parásito. Tinción con hematoxilina y eosina (creado con BioRender.com).
| En el TGI, la inflamación crónica afecta la integridad de la barrera intestinal al alterar las proteínas de las uniones estrechas, lo que lleva a un aumento en la permeabilidad intestinal (“intestino permeable” o “leaky gut”) (Fasano, 2020), causando translocación bacteriana e inflamación sistémica (Ilan, 2012). |
| La respuesta inflamatoria puede ayudar al animal a recuperar la homeostasis tisular si se controla adecuadamente. Sin embargo, los tejidos y órganos se dañan si el estrés y la inflamación persisten (Dal Pont et al., 2020, 2021). |
| Los investigadores pueden usar modelos de inflamación entérica en un entorno de laboratorio para examinar alternativas a los antibióticos promotores de crecimiento (APC) y suplementos dietéticos para aves, por lo que se han desarrollado varios modelos de inflamación intestinal, incluidos dietas altas en NSP (Tellez et al., 2014, 2015; Dal Pont et al., 2021), dexametasona (Vicuña et al., 2015), sulfato de dextrano sódico (Menconi et al., 2015; Zou et al., 2018; Gilani et al., 2017a), restricción/ayuno alimentario (Kuttappan et al., 2015) y estrés térmico (Ruff et al., 2020; Rostagno, 2020). |
La integridad intestinal depende de la función de la barrera. El estrés oxidativo, los factores antinutricionales de la soya, las fuentes de proteína o energía indigestibles, el estrés térmico y la histomoniasis son ejemplos de estresores que pueden resultar en la ruptura de la barrera intestinal (Williams, 2005; Sharma et al., 2007; Pastorelli et al., 2013; Tellez et al., 2014; Biswal et al., 2022).
Sin embargo, como resultado de la eliminación de los APC, han evolucionado nuevas enfermedades multifactoriales que causan enteritis y trastornos intestinales desconocidos en pollos de engorde, lo que afecta negativamente la salud y el rendimiento de las aves (Dahiya et al., 2006; Gholamiandehkordi et al., 2007; Yegani & Korver, 2008).
DISBIOSIS Y DISRUPCIÓN DE LA BARRERA INTESTINAL
La disbiosis, definida como una microbiota anormal a nivel cuali y cuantitativo, desencadena una cascada de eventos en el TGI, incluyendo una disminución en la digestibilidad de nutrientes, inflamación e intestino permeable (Teirlynck et al., 2011; Weiss y Hennet, 2017).
A su vez, una mala salud intestinal se ha relacionado con condronecrosis bacteriana, osteomielitis y cojeras en pollos de engorde (Wideman & Prisby, 2012; Wideman et al., 2015). El correcto funcionamiento de la barrera intestinal es fundamental para la salud general y la homeostasis, y actúa como la primera línea de defensa contra los antígenos ambientales (Jeon et al., 2013).
| La primera capa de la barrera intestinal es la capa de moco extrínseca. Esta capa consta de dos partes: una capa externa de bacterias, que se adhiere ligeramente al epitelio, y una capa interna compuesta por IgA secretora y mucina, que se adhiere a la segunda capa de la barrera intestinal, las células epiteliales intestinales (IECs, por sus siglas en inglés). |
| Estas células epiteliales forman una única capa que separa el lumen intestinal de la lámina propia subyacente (Sakamoto et al., 2000; Kim & Ho, 2010). Estas células epiteliales deben tener la capacidad de recuperarse rápidamente en caso de daño tisular (Audy et al., 2012). |
Los enterocitos en el epitelio apical son responsables de la absorción de nutrientes y las uniones estrechas cierran el espacio paracelular entre las células epiteliales adyacentes en la superficie apical, regulando la permeabilidad de la barrera intestinal al prevenir el ingreso de bacterias y antígenos de manera paracelular a través del epitelio (Ulluwishewa et al., 2011).
A pesar de su origen no hematopoyético, las IECs son un componente crucial de la inmunidad innata en el GALT, realizando una amplia gama de funciones inmunológicas. De hecho, las IECs son capaces de reconocer patógenos mediante la expresión de receptores inmunitarios innatos, liberando moléculas antimicrobianas y secretando una variedad de hormonas, neurotransmisores, enzimas, así como citoquinas y quimiocinas que median la interacción entre las respuestas inmunitarias innatas y adaptativas (Alverdy et al., 2005; Edelblum y Turner, 2009).
| Por lo tanto, cualquier daño a las IECs, ya sea directo o indirecto, puede resultar en un colapso de la barrera intestinal y una posterior alteración de la homeostasis inmune de la mucosa, lo que resulta en una inflamación intestinal crónica y sistémica no controlada (Schulzke et al., 2009; Ilan, 2012). |
| Numerosos investigadores han revelado las vías detrás de la disrupción de las redes proteicas que conectan las células epiteliales mediante mediadores inflamatorios (hormonas, ROS, enzimas y diversas citoquinas proinflamatorias) inducidos por infecciones, elementos del alimento o cualquier otro estrés (Steed et al., 2010; Hu et al., 2013). |
» Otros factores también pueden contribuir a la ruptura de la barrera intestinal: la alimentación con grasa oxidada/no preservada en pollos y cerdos ha incrementado las tasas de recambio del epitelio intestinal y apoptosis en las puntas de las vellosidades (Dibner et al., 1996).
Los metales, al ser pro-oxidantes, pueden producir un estrés oxidativo y ruptura de la barrera (Teirlynck et al., 2009). Simultáneamente, el zinc regula varias proteínas esenciales para la formación de uniones estrechas entre las células del epitelio intestinal, y se ha encontrado que la deficiencia de zinc afecta la función de la barrera (Debon & Tester, 2001; Ulluwishewa et al., 2011).
ESTRÉS E INFLAMACIÓN
El daño e inflamación de bajo grado en el tracto intestinal pueden causar una baja eficiencia alimenticia, lo cual es extremadamente costoso para la industria avícola (Porter, 1998). Factores endógenos y exógenos influyen en el equilibrio homeostático del TGI del huésped (Figura 3).
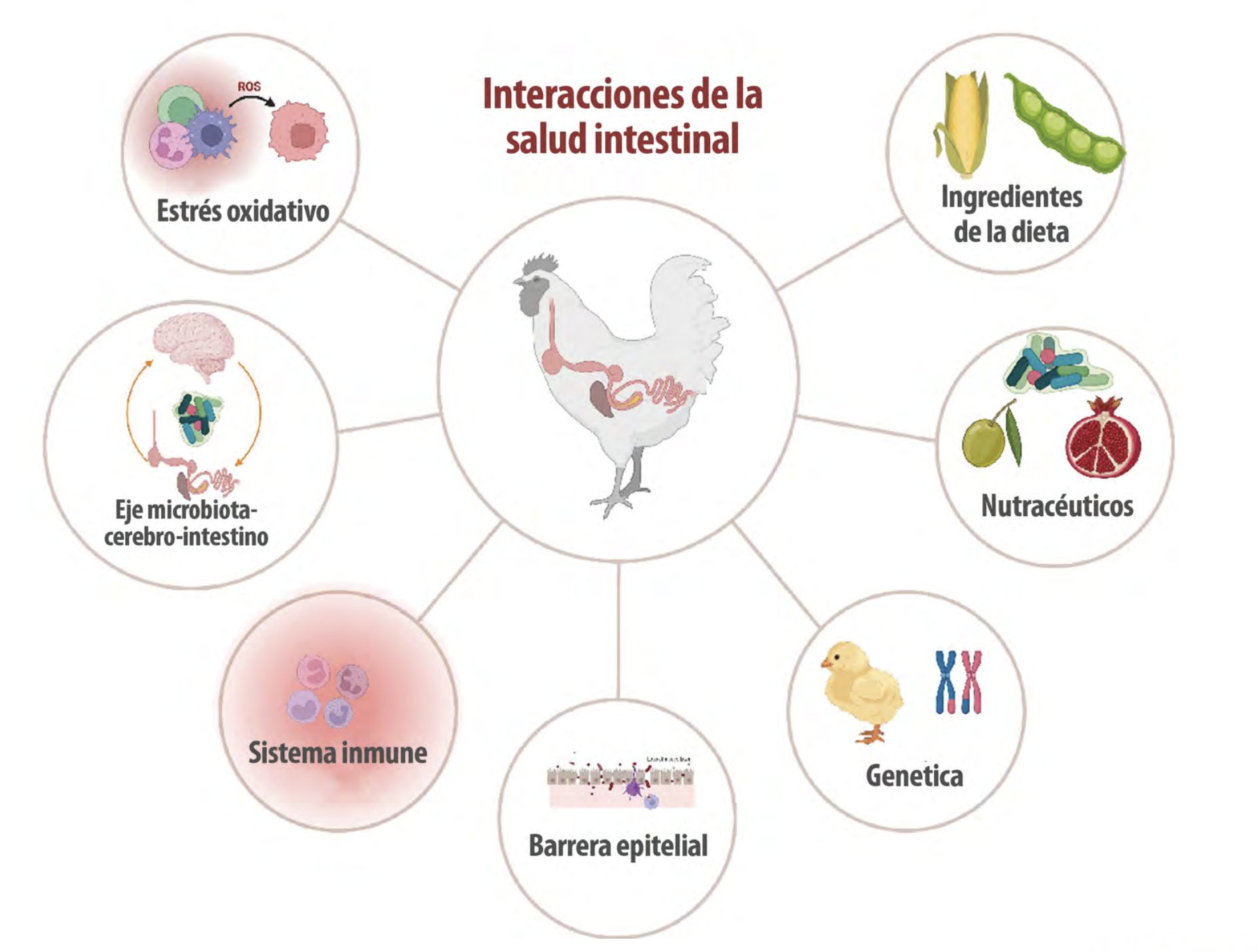
Figura 3. Interacciones entre el huésped y factores intrínsecos o extrínsecos que influyen en la salud intestinal.
| Estos factores representan diferentes tipos de estrés capaces de inducir inflamación y alterar la microflora, causando disbiosis (Iebba et al., 2016). Además, el estrés crónico y la inflamación causan malabsorción, al afectar gravemente la adquisición de nutrientes y la reabsorción de agua (Mishra & Jha, 2019). |
» Determinar el mejor microbioma para los pollos es un área de investigación continua para científicos avícolas, nutricionistas y gerentes de producción. Un microbioma saludable y diverso puede mejorar la salud general, el crecimiento y la productividad de los pollos.
![]() La homeostasis intestinal se define como la ausencia de inflamación y la ausencia de secreciones excesivas (agua o moco) dentro del tracto intestinal (Gabriel et al., 2006). La inflamación fisiológica está en curso durante la homeostasis intestinal como una respuesta controlada para mantener la tolerancia a los antígenos dietéticos y la microbiota comensal y para prevenir daños al epitelio (Kogut et al., 2018).
La homeostasis intestinal se define como la ausencia de inflamación y la ausencia de secreciones excesivas (agua o moco) dentro del tracto intestinal (Gabriel et al., 2006). La inflamación fisiológica está en curso durante la homeostasis intestinal como una respuesta controlada para mantener la tolerancia a los antígenos dietéticos y la microbiota comensal y para prevenir daños al epitelio (Kogut et al., 2018).
Sin embargo, cuando esta se induce, una cascada proinflamatoria promueve un flujo de células inmunitarias y proteínas plasmáticas al área afectada, lo que puede causar secreción excesiva de fluidos, especialmente durante la inflamación crónica (Noguchi et al., 1998).
| La respuesta inflamatoria es un proceso energéticamente costoso, dado que, los nutrientes se desvían hacia la respuesta inflamatoria del huésped, en lugar de destinarse al crecimiento o la acumulación de proteínas (Korver, 2012). |
Se ha encontrado que la inflamación, la fiebre y el metabolismo alterado de los órganos resultan en catabolismo muscular y anorexia durante las respuestas de fase aguda en pollos desafiados con lipopolisacáridos (LPS), reduciendo la ganancia de peso en un 22%, pero solo el 59% de esta reducción se debió a una disminución en la ingesta calórica durante el desafío con LPS.
![]() Por lo tanto, mecanismos adicionales, como la respuesta inmunológica, fueron responsables del 41% de la depresión en la ganancia de peso (Jiang et al., 2010).
Por lo tanto, mecanismos adicionales, como la respuesta inmunológica, fueron responsables del 41% de la depresión en la ganancia de peso (Jiang et al., 2010).
Por otro lado, factores que ralentizan el tiempo de tránsito intestinal e incrementan la viscosidad de la digesta, como las dietas altas en polisacáridos no amiláceos (NSP, por sus siglas en inglés) sin la adición de enzimas exógenas, están asociados con disbiosis e inflamación intestinal (Tellez et al., 2014). La presencia de alimento no digerido en las heces indica un mal funcionamiento del tracto digestivo (Yegani y Korver, 2008).
![]() La inflamación entérica en aves está a menudo relacionada con el paso de alimento no digerido y el aumento de la permeabilidad intestinal. El estrés por calor, los enteropatógenos o las alteraciones en la nutrición pueden causar inflamación intestinal crónica. La inflamación entérica, la muerte de células epiteliales y el intestino permeable afectan la eficiencia alimenticia, la humedad de la cama y el consumo de agua.
La inflamación entérica en aves está a menudo relacionada con el paso de alimento no digerido y el aumento de la permeabilidad intestinal. El estrés por calor, los enteropatógenos o las alteraciones en la nutrición pueden causar inflamación intestinal crónica. La inflamación entérica, la muerte de células epiteliales y el intestino permeable afectan la eficiencia alimenticia, la humedad de la cama y el consumo de agua.
| La capacidad de inducir inflamación intestinal in vivo y las herramientas (biomarcadores) para evaluar tales cambios fisiológicos en aves son de suma importancia para considerar los nutracéuticos como aditivos alimentarios con capacidades prometedoras antioxidantes, antiinflamatorias y moduladoras del sistema inmunológico para ayudar a eliminar las moléculas redox. |
BIOMARCADORES
![]() Como se señaló anteriormente, la salud intestinal abarca una variedad de elementos como el estrés oxidativo, la genética, los ingredientes de la dieta, la barrera intestinal, la interacción microbiota-cerebro-sistema inmune, entre otros.
Como se señaló anteriormente, la salud intestinal abarca una variedad de elementos como el estrés oxidativo, la genética, los ingredientes de la dieta, la barrera intestinal, la interacción microbiota-cerebro-sistema inmune, entre otros.
Cada uno de estos componentes está vinculado entre sí a través de varios mecanismos y vías complejas; sin embargo, identificar algunos elementos clave de la funcionalidad gastrointestinal permite a los científicos evaluar posibles biomarcadores que puedan medir la funcionalidad del TGI de las aves.
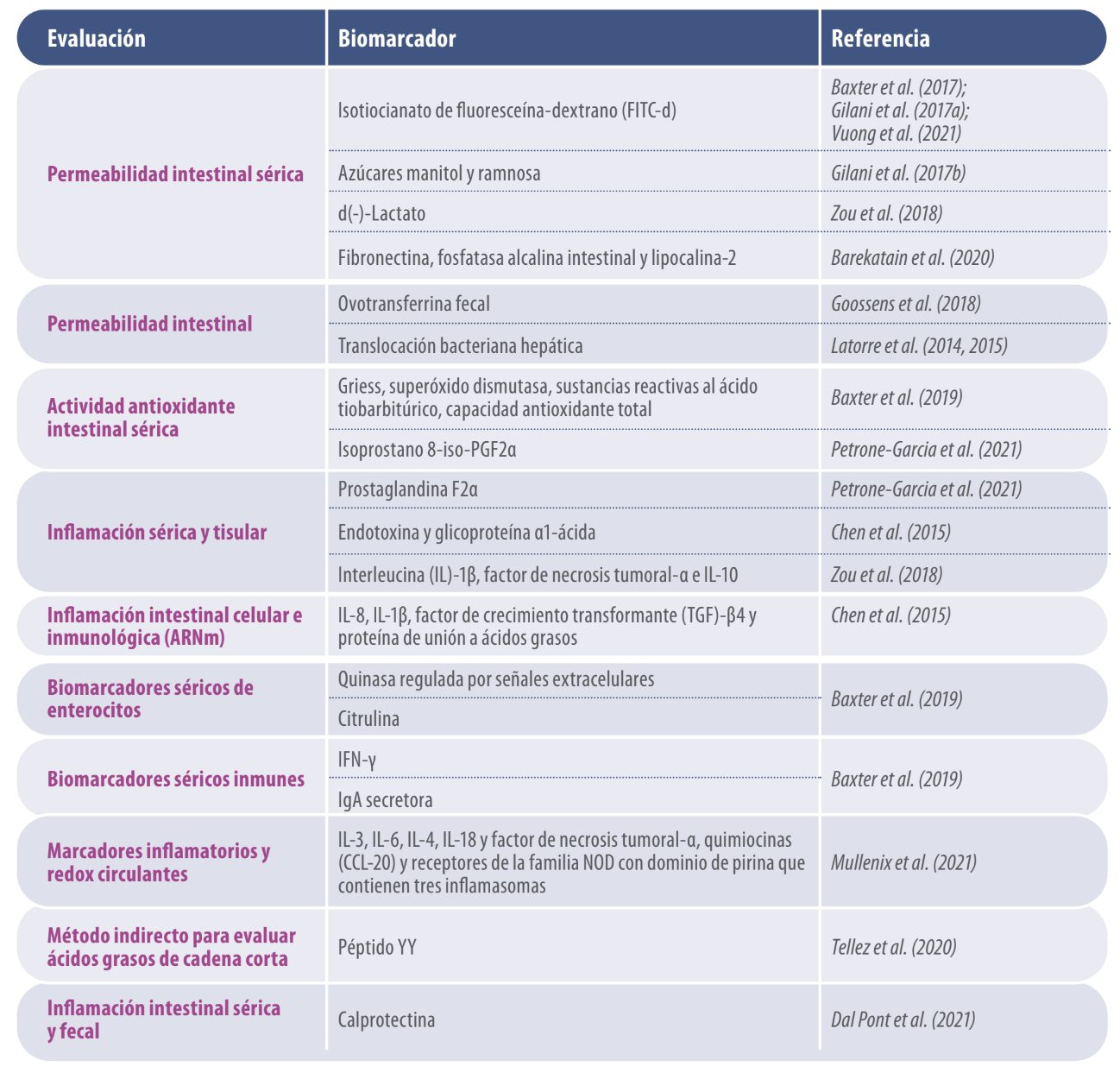
Tabla 1. Biomarcadores para evaluar integridad intestinal en pollos
| Numerosos enfoques, en rápida expansión, están siendo utilizados para crear biomarcadores. En la mayoría de los casos, se deben usar varios biomarcadores para evaluar la funcionalidad del TGI debido a la complejidad de las conexiones entre los componentes fundamentales del rendimiento gastrointestinal. |
ESTRATEGIAS DE MITIGACIÓN
![]() Dado que el origen de la inflamación intestinal y el estrés oxidativo es multifactorial, es importante mencionar que su prevención debe incluir diversos enfoques. El uso de probióticos, prebióticos y sustancias fitogénicas es una de las principales estrategias para mejorar la utilización de nutrientes (Shehata et al., 2022).
Dado que el origen de la inflamación intestinal y el estrés oxidativo es multifactorial, es importante mencionar que su prevención debe incluir diversos enfoques. El uso de probióticos, prebióticos y sustancias fitogénicas es una de las principales estrategias para mejorar la utilización de nutrientes (Shehata et al., 2022).
⊕ Esta estrategia se centra en reducir la colonización de patógenos asociados con la inducción de procesos inflamatorios en el TGI. La compleja interacción de estos microorganismos en relación con la microbiota intestinal juega un papel decisivo en su uso y el efecto correcto en la modulación de la microbiota natural del huésped.
⊕ Junto con el uso de componentes dietéticos como aceites esenciales (Zou et al., 2016) y minerales traza (Chen et al., 2022), resultan ser estrategias posiblemente exitosas para reducir estos efectos negativos de la inflamación crónica y el estrés oxidativo en el TGI.
CONCLUSIÓN
| El estudio y la comprensión de la compleja relación entre la microbiota, la dieta, el ambiente, los factores genéticos, así como los componentes de la dieta de las aves de producción, hacen de este enfoque multidisciplinario una de las ramas de la nutrición con mayor impacto en el futuro ante los desafíos de la producción de alimentos a nivel mundial. |
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en nutriNews
REGISTRARME