Minerales
Información reciente sobre la nutrición de oligoelementos en las aves
GUARDAR EN LA LIBRERÍA PDFPara leer más contenidos de Trimestre 1 LATAM 2021
Minerales
Para leer más contenidos de Trimestre 1 LATAM 2021
Los oligoelementos como el cobre, zinc, manganeso y selenio son esenciales para las funciones corporales críticas y un óptimo rendimiento productivo.
![]() Sin embargo, están apareciendo limitaciones sobre su uso, como en Europa que se redujeron los niveles máximos permitidos de Zn y Cu para disminuir la presión sobre el medio ambiente y una posible correlación con la resistencia a los antibióticos.
Sin embargo, están apareciendo limitaciones sobre su uso, como en Europa que se redujeron los niveles máximos permitidos de Zn y Cu para disminuir la presión sobre el medio ambiente y una posible correlación con la resistencia a los antibióticos.
| Nuevas e innovadoras formas de oligoelementos se encuentran disponibles, avalados por diversas investigaciones que demuestran sus efectos en la producción animal y la biodisponibilidad de las diferentes formas. |
Minerales traza hidroxilados: contrarrestan las interacciones negativas de los componentes presentes en el alimento
La biodisponibilidad de los microminerales depende de la fuerza de la unión del enlace entre el oligoelemento y el resto de la molécula.
Los oligoelementos inorgánicos tienen uniones demasiado fuertes (óxidos) o demasiado débiles (sulfatos), lo que resulta en una baja biodisponibilidad para el animal.
![]() Un enlace fuerte no se disolverá/disociará en el tracto gastrointestinal, no podrá ser absorbido y por lo tanto será excretado.
Un enlace fuerte no se disolverá/disociará en el tracto gastrointestinal, no podrá ser absorbido y por lo tanto será excretado.
![]() Un enlace débil se disolverá/disociará prematuramente en el alimento y en la porción inicial del tracto gastrointestinal. Una vez disociado, el metal ionizado genera interacciones negativas entre varios compuestos del alimento, haciéndolos menos disponibles, incluso al mismo oligoelemento.
Un enlace débil se disolverá/disociará prematuramente en el alimento y en la porción inicial del tracto gastrointestinal. Una vez disociado, el metal ionizado genera interacciones negativas entre varios compuestos del alimento, haciéndolos menos disponibles, incluso al mismo oligoelemento.
Los minerales traza hidroxilados, por el contrario, tienen “enlaces inteligentes”; que aseguran una alta biodisponibilidad y baja formación de complejos insolubles gracias al enlace covalente entre el oligoelemento y los otros átomos que forman el mineral, asegurando una liberación lenta y dirigida en el sitio de absorción.
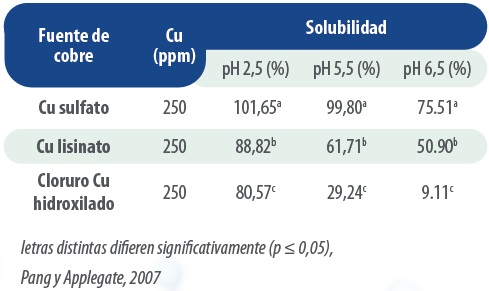
La prueba de solubilidad in vitro muestra que el cloruro de cobre hidroxilado tiene una solubilidad significativamente menor en todos los valores de pH probados, esto reduce la formación de complejos insolubles.
Tabla 1: solubilidad in vitro de diferentes fuentes de Cobre
En el gráfico 1 se demuestra una alta reducción de la eficacia de la fitasa cuando se combina con diversas fuentes de cobre, a distintas inclusiones y a pH 5,5. El cloruro de cobre hidroxilado (TBCC) no mostró ningún impacto negativo y resultó en una respuesta similar al lisinato de cobre.
Gráfico 1: Efecto de la fuente y concentración de Cu sobre la eficacia de la fitasa a pH 5,5
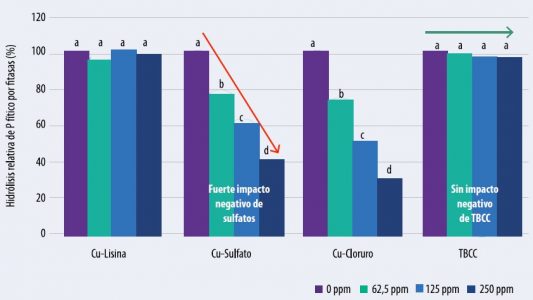
Letras diferentes difieren significativamente (P ≤ 0.05).
TBCC = Cloruro de Cobre Tribásico = Cloruro de Cobre hidroxilado.
Extraído de Pang y Applegate (2006).
![]() Otro estudio mostró que el cloruro de cobre hidroxilado mejoró en un 17% la retención de unidades de fitasa frente al sulfato de cobre, en un alimento molido de ponedoras en 427 vs 366 unidades de fitasa/kg por una menor oxidación de la fitasa durante el almacenamiento del alimento.
Otro estudio mostró que el cloruro de cobre hidroxilado mejoró en un 17% la retención de unidades de fitasa frente al sulfato de cobre, en un alimento molido de ponedoras en 427 vs 366 unidades de fitasa/kg por una menor oxidación de la fitasa durante el almacenamiento del alimento.
Gráfico 2: Efecto del sulfato de Cu y del cloruro de cobre hidroxilado sobre la retención de fitasa
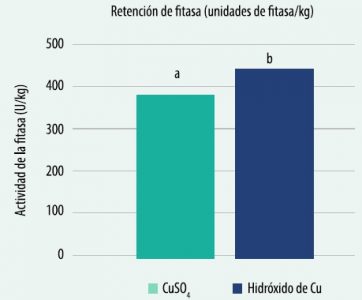
Letras diferentes difieren estadísticamente entre sí (P <0.05).
Extraído de Liu et al., 2005
El cobre soluble disociado también tiene un efecto negativo sobre el contenido de grasa en los alimentos, ya que puede iniciar el ciclo de oxidación de los lípidos actuando como catalizador en la formación de radicales libres, reduciendo así el valor nutricional de la grasa.

Miles et al. (1998) mostraron una gran diferencia entre la capacidad de oxidación del sulfato de cobre de partícula gruesa y fina y el cloruro de cobre hidroxilado. Estos autores observaron que:

La estabilidad del aceite de soja frente al daño oxidativo fue mayor para los minerales traza hidroxilados en comparación con los sulfatos (Kampf et al., 2012).

| Para evaluar el efecto de liberación lenta del cloruro de cobre hidroxilado en todo el TGI, se realizó un estudio in vivo (Naziripour y Klasing, 2010) en pollos de engorde que se alimentaron con 150ppm de Cu, a partir de sulfato de Cu y cloruro de cobre hidroxilado, durante 2 semanas (día 3-14). La cantidad de Cu (mg/kg MS) se dividió en Cu soluble e insoluble (no disponible para fines nutricionales y microbicidas).
|
Selenio en la alimentación: todo sobre la L-selenometionina
En la actualidad aún se utiliza selenito de sodio en gran medida en la fabricación de alimentos balanceados.
![]() Las fuentes de selenio orgánico se evalúan según el contenido de L- Selenometionina (L-SeMet), que es la única forma que el selenio se puede acumular de misma manera que la metionina, en la fracción proteica de tejidos y productos animales (leche, huevos, carne).
Las fuentes de selenio orgánico se evalúan según el contenido de L- Selenometionina (L-SeMet), que es la única forma que el selenio se puede acumular de misma manera que la metionina, en la fracción proteica de tejidos y productos animales (leche, huevos, carne).
Un estudio (Van Beirendonck et al., 2016) demostró mayor deposición de Se en forma L-SeMet en la pechuga de pollos de engorde, en comparación con otras fuentes orgánicas e inorgánicas de selenio (Gráfico 3).
En la prueba se incorporaron 2 levaduras de Se del mercado (29% y 45% de L-SeMet), las 2 mostraron una deposición de Se significativamente menor en comparación con la L-SeMet, a igual inclusión (0,20 mg/kg) .
Van Beirendonck et al. (2016) midieron la deposición de Se en función de la concentración de la L-SeMet de la dieta y observaron que la deposición de Se en músculo es linealmente proporcional a la concentración de L-SeMet en el producto, y es un indicador de la calidad de la levadura selenizada agregada.

Gráfico 3. Deposición de Se en el músculo de pollo de engorde (μg/kg) al día 14 después de la suplementación con diferentes fuentes de Se.
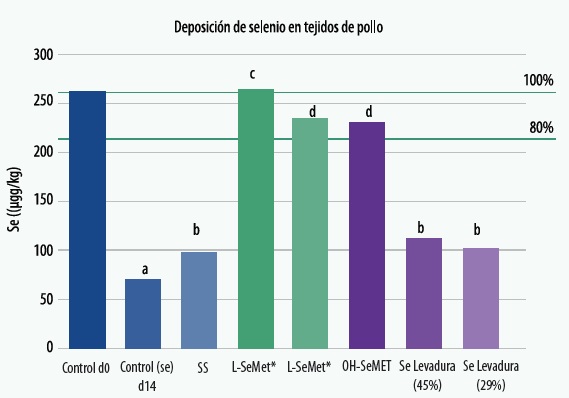
Todas las fuentes se añadieron a 0,2 mg/kg de Se en el alimento, con excepción de XC Sel4000, que se añadió a 0,16 y 0,20 mg/kg de Se en el alimento.
Fuente: Van Beirendonck et al. 2018
La OH-SeMet tiene una menor deposición de Se en el músculo en comparación con la L- SeMet cuando se incorpora al mismo nivel de inclusión (0,20 mg/kg). La deposición de selenio en el músculo confirma la eficacia del 80% para la conversión de OH-SeMet en L-SeMet en el animal, como se describe para la OH-Metionina (EFSA Journal 2012; 10 (3): 2623).
Gráfico 4: Deposición de Se en huevos (μg / kg) después de 56 días de tratamiento.
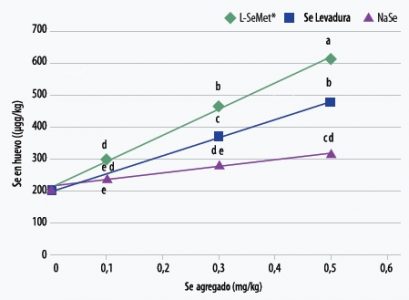
Letras diferentes difieren significativamente (p <0.05).
Delezie et al., 2014
La inclusión del 80% de la dosis de L-SeMet (0,16 mg/kg) correspondiente al 100% de la dosis de OH-Se-Met (0,20 mg/kg), dio como resultado una deposición similar de Se en el tejido.
Además de la deposición en carne, la transferencia más eficiente de Se a los huevos se puede lograr agregando L-SeMet (Gráfico 4) (Delezie et al., 2014). El estudio demostró mayor deposición de Se en huevo cuando se adicionó L-SeMet, frente a la levadura de Se y al selenito de sodio.
Mayor deposición de L-SeMet asegura una transferencia óptima de Se al animal y a su descendencia, aumentando la reserva de Se y reduciendo el estrés oxidativo. Xiao et al. (2016) demostraron una reducción del estrés en embriones de pollo (P<0.05) al aumentar la reserva de selenio a través de L-SeMet en reproductoras pesadas.
Aumentar las reservas de selenio usando L-SeMet benefician no solo al animal que lo consume (parámetros zootécnicos, fertilidad, estado antioxidante), sino también a su progenie y a los consumidores que confían en los productos que consumen.
La L-SeMet* mencionada en el artículo y puesta en prueba fue XC Sel4000.
Referencias disponibles bajo petición
MÁS CONTENIDOS DE ORFFA Additives B.V.