Novas abordagens para avaliar a eficácia dos adsorventes de micotoxinas
As micotoxinas representam um desafio significativo para a produção animal, estando a sua prevalência em matérias-primas ou rações sujeita a variações relacionadas com alterações nas condições climáticas.
Por exemplo, secas ou anos com muita pluviosidade afetam o tipo de fungos que proliferam em determinadas regiões (Moretti et al., 2019).
Existem diferentes métodos para controlar o impacto das micotoxinas na produção animal, desde o controle da sua presença nas matérias-primas durante a pré e pós-colheita, até à desintoxicação dos animais expostos a elas através de dietas contaminadas.
O uso de adsorventes de micotoxinas (ADS) é amplamente reconhecida como uma estratégia eficaz para minimizar os efeitos das micotoxinas em animais contaminados (Galvano et al., 2001).
Os adsorventes de micotoxinas são ativos no trato gastrointestinal dos animais, com as micotoxinas fixando-se na matriz adsorvente por meio de diferentes interações físico-químicas.
Existem diferentes tipos de adsorventes, sendo os mais comuns as argilas, o carvão ativado (CA) e a parede celular de levedura (LEV), cujo espaço interlaminar, poros e β-glucanos representam seus principais fatores de adsorção, respectivamente (Jouany, 2007).
Principais adsorventes de micotoxinas [cadastrar]

 Para determinar a eficácia dos adsorventes de micotoxinas, utiliza-se principalmente testes in vitro que permitem a avaliação de um amplo número de adsorventes e micotoxinas com a vantagem de serem testes rápidos e econômicos em comparação aos testes in vivo.
Para determinar a eficácia dos adsorventes de micotoxinas, utiliza-se principalmente testes in vitro que permitem a avaliação de um amplo número de adsorventes e micotoxinas com a vantagem de serem testes rápidos e econômicos em comparação aos testes in vivo.
Porém, existem muitas variantes de testes in vitro que foram desenvolvidas ao longo dos anos tentando simular os processos do trato gastrointestinal dos animais.
O problema com estes métodos é a alta variabilidade dos resultados de adsorção de micotoxinas.
| Esses protocolos variam em complexidade, desde um simples teste com água destilada e incubação em temperatura ambiente (Lemke et al., 2001) até métodos mais complexos que simulam os processos do trato gastrointestinal de animais utilizando diferentes pH e incluindo enzimas gastrointestinais, ou utilizando suco gástrico como meio de incubação (Avantaggiato et al., 2004; Gallo e Masoero, 2010). |
 Infelizmente, esta diversidade de protocolos experimentais resultou numa grande variabilidade nos resultados da capacidade de adsorção dos adsorventes (Kihal et al., 2022).
Infelizmente, esta diversidade de protocolos experimentais resultou numa grande variabilidade nos resultados da capacidade de adsorção dos adsorventes (Kihal et al., 2022).
DISCUSSÃO COMPARATIVA SOBRE A CAPACIDADE DE ADSORÇÃO DE ADSORVENTES ENTRE ESTUDOS IN VITRO E IN VIVO
Determinar a capacidade de adsorção de micotoxinas em testes in vivo é essencial para demonstrar a real eficácia do produto.
O contrário dos testes in vitro, os testes in vivo replicam as condições de campo e a resposta do animal à suplementação de adsorventes na presença de micotoxinas nas dietas.
 Para esclarecer melhor a concordância dos resultados de estudos in vitro e in vivo, foi realizado um estudo de meta-análise em rede com base em dados publicados na literatura de estudos que avaliaram a eficácia de diferentes adsorventes na redução da concentração de aflatoxina M1 (AFM1)e sua transferência da ração para o leite após desafiar vacas leiteiras com AFB1 (Kihal et al., 2023).
Para esclarecer melhor a concordância dos resultados de estudos in vitro e in vivo, foi realizado um estudo de meta-análise em rede com base em dados publicados na literatura de estudos que avaliaram a eficácia de diferentes adsorventes na redução da concentração de aflatoxina M1 (AFM1)e sua transferência da ração para o leite após desafiar vacas leiteiras com AFB1 (Kihal et al., 2023).
A principal conclusão deste estudo foi que a eficácia de diferentes fontes adsorventes [carvão ativado (AC), bentonita, aluminossilicatos (HSCAS), parede celular de levedura (LEV) e uma mistura de adsorventes (MIX)] reduziu significativamente a porcentagem de AFM1 em leite em comparação com o controle.
É importante notar que o número de estudos in vivo foi inferior ao número de estudos in vitro incluídos nesta meta-análise (28 vs. 68 artigos).
![]() Esta diferença pode ter um efeito na variabilidade dos resultados, levando a uma alta variabilidade entre as comparações de tratamento.
Esta diferença pode ter um efeito na variabilidade dos resultados, levando a uma alta variabilidade entre as comparações de tratamento.
| Desafios e limitações dos estudos in vivo |
Os estudos in vivo, ao contrário dos testes in vitro, são complicados, caros e difíceis de aplicar:
Além disso, tal como os testes in vitro, os estudos in vivo devem ser realizados em condições experimentais para evitar resultados enganosos.
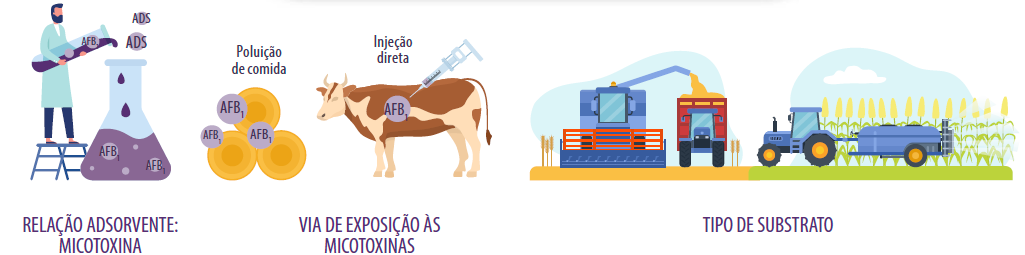
PROPORÇÃO ADSORVENTE:MICOTOXINA
Definição da dose do adsorvente:micotoxina é um problema comum em estudos in vitro e in vivo, pois trabalhar com proporções inadequadas pode favorecer ou desfavorecer os resultados de adsorção de micotoxinas.
VIA DE EXPOSIÇÃO
A forma como os alimentos são contaminados em trabalhos experimentais também é um fator chave na avaliação da capacidade de adsorção.
Por exemplo, a suplementação de ração naturalmente contaminada pode afetar os resultados em comparação com a suplementação de AFB1 puro diretamente no rúmen da vaca.
Isto ocorre porque os alimentos naturalmente contaminados podem conter diferentes tipos de aflatoxinas (AFB1, AFB2, AFG1 ou AFG2) ou outras micotoxinas, resultando em fenômenos de sinergia ou competição para ligação ao adsorvente testado.
TIPO DE SUBSTRATO
A matéria-prima utilizada para o desenvolvimento do fungo é muito importante, pois os fungos utilizam os nutrientes do grão contaminado para seu crescimento e a utilização de diferentes tipos de grãos também pode afetar o desenvolvimento do fungo e a produção de micotoxinas.
| Ainda assim, os experimentos in vivo são o melhor método para testar a eficácia dos adsorventes e permitir uma compreensão mais profunda de como os produtos funcionam em animais. |
Parâmetros importantes em estudos in vivo da eficácia de adsorventes de micotoxinas
 A revisão dos resultados dos estudos in vitro e in vivo dos adsorventes (Kihal et al., 2023) permitiu confirmar que a sua capacidade de adsorção de aflatoxinas in vitro era semelhante às experiências in vivo onde diferentes adsorventes (carvão ativado, bentonite e HSCAS ) diminuiu com sucesso a concentração de AFM1 no leite numa faixa de 26-45%.
A revisão dos resultados dos estudos in vitro e in vivo dos adsorventes (Kihal et al., 2023) permitiu confirmar que a sua capacidade de adsorção de aflatoxinas in vitro era semelhante às experiências in vivo onde diferentes adsorventes (carvão ativado, bentonite e HSCAS ) diminuiu com sucesso a concentração de AFM1 no leite numa faixa de 26-45%.
Ressalta-se que o uso dos adsorventes in vivo resultou em menor capacidade de adsorção em comparação aos resultados in vitro, com diminuição de mais de 50% para CA, bentonita e LEV, e diminuição de 67% para HSCAS.
 Neste sentido, sugere-se que, em condições in vivo, o conteúdo do trato gastrointestinal (enzimas, nutrientes, bactérias) interfere e compete com as micotoxinas pelos sítios de adsorção dos adsorventes, levando a uma diminuição da capacidade geral, o que contrasta com condições in vitro onde o meio de incubação contém menos moléculas orgânicas.
Neste sentido, sugere-se que, em condições in vivo, o conteúdo do trato gastrointestinal (enzimas, nutrientes, bactérias) interfere e compete com as micotoxinas pelos sítios de adsorção dos adsorventes, levando a uma diminuição da capacidade geral, o que contrasta com condições in vitro onde o meio de incubação contém menos moléculas orgânicas.
QUAL O POTENCIAL DOS ADSORVENTES DE MICOTOXINAS PARA INTERFERIR NA ADSORÇÃO DE OUTROS NUTRIENTES E QUAL A MELHOR FERRAMENTA PARA VERIFICAR, IN VITRO OU IN VIVO?
Estudos recentes em nosso laboratório demonstraram que a capacidade de adsorção pode ser influenciada por alguns fatores como:
Além disso, esta capacidade poderia ser alterada pela interação de nutrientes presentes no mesmo ambiente com micotoxinas, tanto in vivo quanto in vitro.
O mecanismo de adsorção dos adsorventes não é seletivo para apenas se ligarem as micotoxinas, mas também podem adsorver outras moléculas presentes no trato gastrointestinal do animal, como nutrientes.
Essa capacidade de ligação aos nutrientes é atribuída às semelhanças físico-químicas de alguns nutrientes com as micotoxinas que permitem sua interação.
| Estudos in vitro sobre capacidade de adsorção de nutrientes |
A capacidade dos adsorventes de adsorver nutrientes foi estudada usando modelos in vitro.
![]() Kihal et al. (2020; 2021) estudaram a interação de seis adsorventes diferentes com aminoácidos e vitaminas.
Kihal et al. (2020; 2021) estudaram a interação de seis adsorventes diferentes com aminoácidos e vitaminas.
![]() Vekiru et al. (2007) também observaram que o AC adsorveu grande proporção de vitamina B8 (78%) e B12 (99%), enquanto a bentonita teve menor adsorção de vitamina B12 (47%).
Vekiru et al. (2007) também observaram que o AC adsorveu grande proporção de vitamina B8 (78%) e B12 (99%), enquanto a bentonita teve menor adsorção de vitamina B12 (47%).
![]() Barrientos-Velázquez et al. (2016) relataram que a bentonita absorveu 34% da vitamina B1 e que, paralelamente, a adsorção da aflatoxina foi reduzida em 34%, indicando competição direta de outros nutrientes pelos locais de adsorção.
Barrientos-Velázquez et al. (2016) relataram que a bentonita absorveu 34% da vitamina B1 e que, paralelamente, a adsorção da aflatoxina foi reduzida em 34%, indicando competição direta de outros nutrientes pelos locais de adsorção.
![]() Mortland et al. (1983) relataram que o esmético tem capacidade de adsorver vitamina B2 (50%).
Mortland et al. (1983) relataram que o esmético tem capacidade de adsorver vitamina B2 (50%).
![]() Observou-se também que a bentonita e a montmorilonita adsorvem proteínas em um modelo in vitro (Ralla et al., 2010; Barrientos-Velázquez et al., 2016).
Observou-se também que a bentonita e a montmorilonita adsorvem proteínas em um modelo in vitro (Ralla et al., 2010; Barrientos-Velázquez et al., 2016).
![]() A capacidade dos adsorventes de adsorver minerais também foi investigada in vitro por Tomasevic-Canovic et al. (2001) que observaram uma alta capacidade da bentonita em adsorver cobre (56%) e cobalto (73%), enquanto a adsorção de zinco (12%) e manganês (12%) foi relativamente baixa.
A capacidade dos adsorventes de adsorver minerais também foi investigada in vitro por Tomasevic-Canovic et al. (2001) que observaram uma alta capacidade da bentonita em adsorver cobre (56%) e cobalto (73%), enquanto a adsorção de zinco (12%) e manganês (12%) foi relativamente baixa.
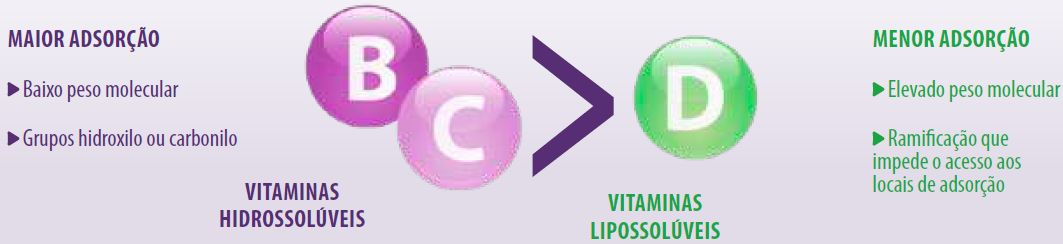
Por outro lado, as vitaminas A, D, B3, B5 e B8, e os aminoácidos triptofano e fenilalanina, não foram adsorvidos pela bentonita e pela zeólita (Tomasevic- Canovic et al., 2001; Vekiru et al., 2007; Kihal et al., 2020).
Esses resultados foram atribuídos principalmente às propriedades físico-químicas de cada nutriente.
A capacidade de adsorção das vitaminas hidrossolúveis foi maior devido ao seu baixo peso molecular e à presença de mais de um grupo hidroxila ou carbonila que garante uma adsorção estável com os adsorventes.
A adsorção da vitamina D foi menor devido ao maior peso molecular e à presença de diferentes ramificações que impedem sua entrada nos sítios de adsorção do adsorvente.
Capacidade de adsorção das vitaminas
Apesar destes resultados, existem problemas técnicos na aplicação destes métodos a alguns nutrientes, uma vez que alguns deles são sensíveis a fatores ambientais e podem sofrer alterações durante a incubação.
![]() Kihal et al. (2021) observaram que a vitamina A desapareceu do meio de incubação após 4 horas de incubação, o que não permite sua avaliação, enquanto as vitaminas D e E foram mais estáveis durante a cinética de degradação e apresentaram estabilidade superior a 90%.
Kihal et al. (2021) observaram que a vitamina A desapareceu do meio de incubação após 4 horas de incubação, o que não permite sua avaliação, enquanto as vitaminas D e E foram mais estáveis durante a cinética de degradação e apresentaram estabilidade superior a 90%.
![]() Díaz et al. (2004) apontaram que os resultados dos testes in vitro não devem ser considerados como resultados finais e sugeriram que estudos in vivo deveriam ser realizados para obter resultados mais confiáveis.
Díaz et al. (2004) apontaram que os resultados dos testes in vitro não devem ser considerados como resultados finais e sugeriram que estudos in vivo deveriam ser realizados para obter resultados mais confiáveis.
Figura 1. Avaliação da estabilidade vitamínica solúvel em gordura no meio de incubação.
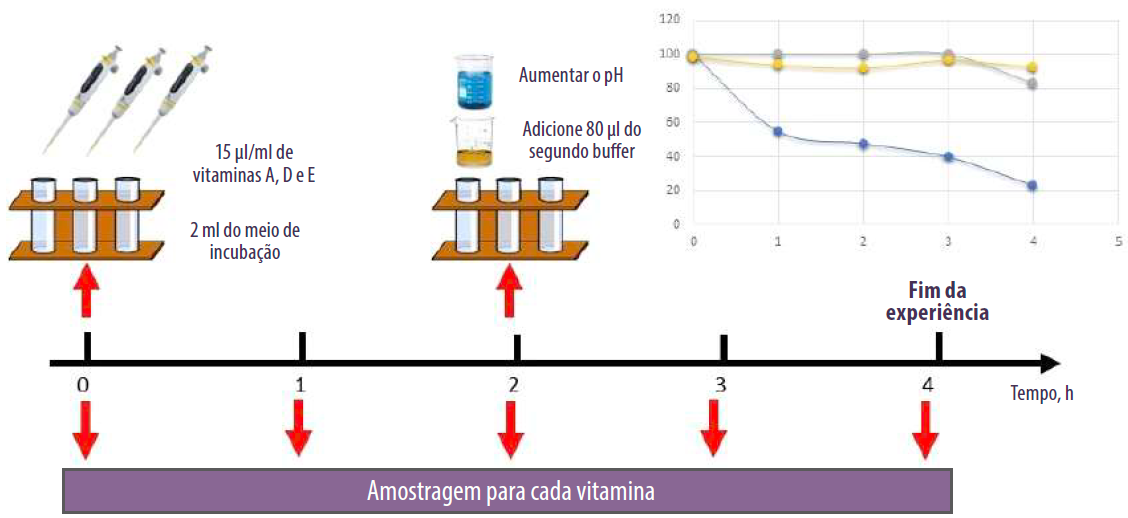
Estabilidade de vitaminas lipossolúveis durante a cinética de degradação

| Estudos in vivo sobre capacidade de adsorção de nutrientes |
A biodisponibilidade de nutrientes na presença de adsorventes também foram estudadas in vivo.
![]() Briggs y Fox (1956) observaram que a suplementação de dietas de frango com 2-3% de bentonita resultou em deficiência de vitamina A.
Briggs y Fox (1956) observaram que a suplementação de dietas de frango com 2-3% de bentonita resultou em deficiência de vitamina A.
![]() O conteúdo de zinco também diminuiu nos ossos de galinha após terem sido suplementados com HSCAS de 0,5 a 1% da dieta (Chung et al., 1989).
O conteúdo de zinco também diminuiu nos ossos de galinha após terem sido suplementados com HSCAS de 0,5 a 1% da dieta (Chung et al., 1989).
![]() Afriyie-Gyawu (2004) y Pimpukdee et al. (2004) observaram que a inclusão de 0,5% de bentonita não afetou a concentração de vitamina A no fígado e Chung et al. (1989) descobriram que a inclusão de HSCAS não afetou a biodisponibilidade de vitamina A, vitamina B2 e manganês em pintinhos.
Afriyie-Gyawu (2004) y Pimpukdee et al. (2004) observaram que a inclusão de 0,5% de bentonita não afetou a concentração de vitamina A no fígado e Chung et al. (1989) descobriram que a inclusão de HSCAS não afetou a biodisponibilidade de vitamina A, vitamina B2 e manganês em pintinhos.
![]() Sulzberger et al. (2016) y Kihal et al. (2022), após suplementação de vacas leiteiras com 1,2 e 2% de montmorilonita na dieta de vacas leiteiras, também não observaram alterações na concentração plasmática das vitaminas A, D, E, B1 e B6.
Sulzberger et al. (2016) y Kihal et al. (2022), após suplementação de vacas leiteiras com 1,2 e 2% de montmorilonita na dieta de vacas leiteiras, também não observaram alterações na concentração plasmática das vitaminas A, D, E, B1 e B6.
![]() Maki et al. (2016) suplementaram HSCAS para vacas leiteiras com 1,2% da matéria seca da dieta e não observaram efeitos negativos na biodisponibilidade das vitaminas A e B2 no leite.
Maki et al. (2016) suplementaram HSCAS para vacas leiteiras com 1,2% da matéria seca da dieta e não observaram efeitos negativos na biodisponibilidade das vitaminas A e B2 no leite.
Estes resultados podem sugerir que os testes in vitro não são totalmente confiáveis e devemos ser muito conservadores quando nos referimos a tais resultados.
RECOMENDAÇÕES PARA MELHORAR A PRECISÃO DE TESTES IN VITRO E IN VIVO
| Razões padronizadas entre adsorvente:micotoxina |
Além dos fatores que limitam a interação específica entre adsorventes e micotoxinas, o mecanismo de adsorção dos adsorventes é saturável e depende do número de locais de adsorção disponíveis para micotoxinas na matriz.
Por esta razão, a relação adsorvente:micotoxina é um fator essencial para testes in vitro onde a capacidade de adsorção pode ser facilmente manipulada:
Usando dados selecionados para a análise da eficácia do adsorvente in vitro, as proporções adsorvente:micotoxina utilizadas nas técnicas atuais resultaram em uma gama muito ampla de proporções, independentemente do tipo de micotoxina ou adsorvente (1:0,00007 a 1:600 mg/μg, Tabela 1).
Tabela 1. Faixas da proporção de micotoxinas e adsorventes de micotoxinas (mg:μg) usadas em testes in vitro para determinar a capacidade de adsorção de diferentes micotoxinas e adsorventes de micotoxinas.
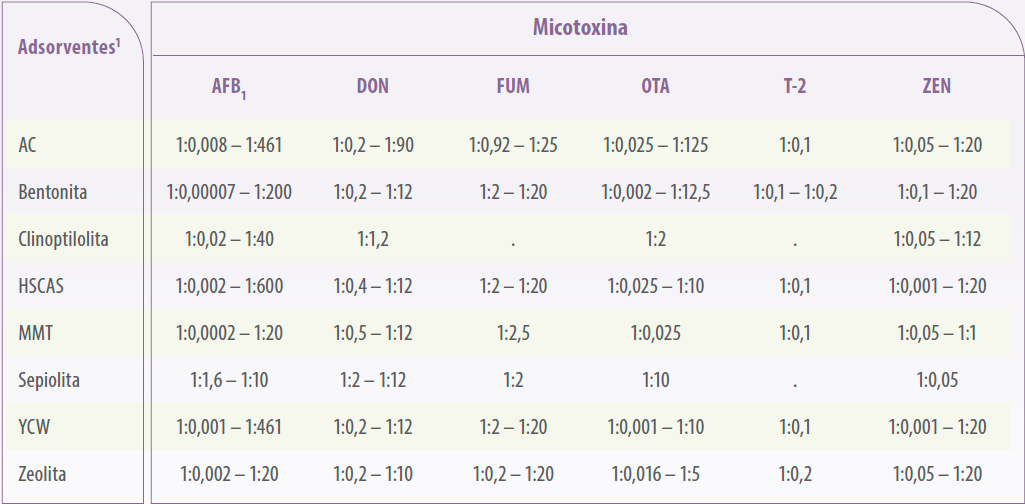
| Será relevante estabelecer uma relação adsorvente:micotoxina padronizada que deverá ser utilizada em testes in vitro, a fim de fazer comparações justas. |
A EFSA (2017) considera que os adsorventes são seguros e estabelece doses limites de segurança elevadas (20 kg/t de ração).
As doses de adsorventes de micotoxinas atualmente recomendadas são geralmente estabelecidas por empresas de marketing de adsorventes que realizam testes in vitro utilizando diferentes doses de inclusão de adsorvente.
Esta dose necessária difere dependendo do tipo de adsorvente, alterando as propriedades químicas como a composição química e natureza do adsorvente. No entanto, deverá ser possível recomendar uma série de proporções que devem ser seguidas durante experiências in vitro.
 Díaz et al. (2004) recomendaram concentração de 1,2% de matéria seca diária do adsorvente equivalente a 300g/dia/vaca. Contudo, a ingestão diária de micotoxinas é altamente variável e depende do tipo de micotoxina.
Díaz et al. (2004) recomendaram concentração de 1,2% de matéria seca diária do adsorvente equivalente a 300g/dia/vaca. Contudo, a ingestão diária de micotoxinas é altamente variável e depende do tipo de micotoxina.
Portanto, é razoável propor uma dose adequada relacionada aos níveis tóxicos mínimos de cada micotoxina avaliados pela Comissão Europeia (CE, 2006 sobre matérias-primas).
Para padronizar um protocolo in vitro, propomos utilizar uma relação adsorvente:micotoxina próxima à encontrada em condições de campo.
Como as micotoxicoses ocorrem em animais com altas concentrações de micotoxinas, propomos utilizar a concentração tóxica mínima para cada micotoxina multiplicada por 10 para testes in vitro.
Então, a ingestão diária será 10 vezes superior aos limites tóxicos mínimos, considerando um consumo médio para cada espécie animal.
|
CONCENTRAÇÃO DE MICOTOXINAS EM TESTES IN VITRO 10 X CONCENTRAÇÃO TÓXICA MÍNIMA DE MICOTOXINA |
Esta relação adsorvente:micotoxina (mg/μg) deve permitir avaliar a capacidade dos adsorventes de adsorver níveis tóxicos de micotoxinas em uma proporção apropriada.

| Padronização de testes in vitro |
Um procedimento padronizado também deve considerar outros aspectos, como características e volume do meio de incubação, duração e pH, entre outros.
| Processo de validação de teste in vitro |
Finalmente, como qualquer teste in vitro, seria necessária validação.
Contudo, é muito difícil realizar testes in vivo para fornecer dados suficientes para cada adsorvente e cada micotoxina para o processo de validação, o que aumenta a dificuldade de desenvolver um teste confiável e validado.
CONCLUSÕES
Devido à variabilidade nos resultados e aos dados limitados disponíveis, é importante:
1. Padronizar um método in vitro para avaliar a capacidade dos adsorventes em adsorver micotoxinas e outros nutrientes in vitro.
2. Validar os resultados com testes in vivo.
Os atuais protocolos in vitro utilizados para avaliar adsorventes são concebidos como um método de triagem, sendo utilizados principalmente durante o desenvolvimento de produtos porque fornecem informações rápidas e baratas sobre a eficácia dos produtos.
O desafio atual é desenvolver um novo método validado que forneça resultados confiáveis para diferentes adsorventes de micotoxinas.
Um método validado também pode ser usado como procedimento de refinamento para substituir estudos in vivo que são caros e complicados de implementar.
Referências disponíveis mediante solicitação.
Artigo original de mycotoxinsite.com [/cadastrar]