Os peixes de água doce podem ser fonte de ômega 3?
 Os ácidos graxos poli-insaturados (PUFA – polyunsaturated fatty acids), linoleico (18:2n6 – LA) e linolênico (18:3n3 – ALA) não podem ser sintetizados pelos humanos sendo então considerados nutricionalmente essenciais, e precisam ser obtidos via alimentação.
Os ácidos graxos poli-insaturados (PUFA – polyunsaturated fatty acids), linoleico (18:2n6 – LA) e linolênico (18:3n3 – ALA) não podem ser sintetizados pelos humanos sendo então considerados nutricionalmente essenciais, e precisam ser obtidos via alimentação.
Os ácidos graxos da série ômega 3 (n3) são amplamente reconhecidos como sendo um nutriente essencial para a saúde e bem-estar de seres humanos, particularmente no que diz respeito aos ácidos graxos poli-insaturados de cadeia longa (n-3 LC-PUFA – long chain polyunsaturated fatty acids), eicosapentaenoico (EPA; 20: 5n-3) e docosahexaenóico (DHA, 22: 6n-3), que exercem uma variedade de benefícios para a saúde através da sua ação molecular, celular e fisiológica.
Os n3 LC-PUFA, DHA, para as membranas biológicas e a importância de EPA, pelos seus efeitos a nível vascular (ações antitrombóticas e anti-inflamatórias) exercidas através do metabolismo dos eicosanoides.
A deficiência de desses ácidos graxos da série n3 estão associados a dermatite escamosa, alopecia, trombocitopenia e, em crianças, deficiência intelectual. Assim, são especialmente importantes entre os alimentos funcionais; prova disto, é a recomendação de organizações profissionais para um consumo individual diário de 500mg desses ácidos graxos, que proporcionaria benefícios à saúde.
Os peixes são a principal fonte alimentar de n-3 LC-PUFA para os seres humanos, sendo uma excelente fonte de proteína, vitaminas e minerais. Recomendações para os níveis de ingestão diária recomendada de EPA e DHA variam enormemente, dependendo da organização científica. No entanto, a maioria dessas organizações recomendam o consumo de pelo menos duas porções de peixe por semana, uma das quais deve ser de peixe gordo, com elevada concentração de n-3 LC-PUFA (Aha, 2015).
A biossíntese de EPA, DHA e ARA endógena é possível para a maioria dos organismos superiores a partir dos compostos da série n3 e n6 de 18 carbonos.
Nesse processo de biossíntese dos LC-PUFA da série n-3 e n6 (Figura 1), é necessário a introdução de carbonos e duplas ligações catalisadas por enzimas específicas: as elongases e as dessaturases. [registrados]
Esse complexo enzimático converte o 18:2n – 6 em 20:4n-6 (ARA), e 18:3n-3 em 20:5n-3 (EPA) e 22:6n-3 DHA (Li et al., 2010).
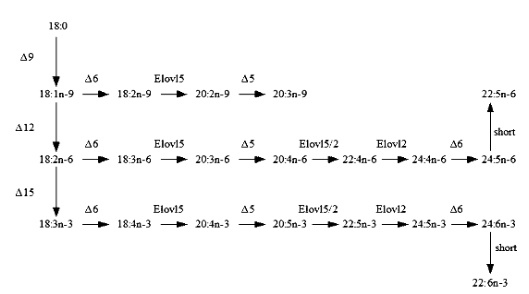
Figura 1- Processo biosintético dos n-3/6 LC-PUFA (ARA, EPA e DHA)
Fonte: Tocher et al. (2010)
Os peixes são a principal fonte alimentar de n-3 LC-PUFA para os seres humanos, sendo também uma excelente fonte de proteína, vitaminas e minerais.
Recomendações para os níveis de ingestão diária recomendada de EPA e DHA variam enormemente, dependendo da organização científica. No entanto, a maioria dessas organizações recomendam o consumo de pelo menos duas porções de peixe por semana, uma das quais deve ser de peixe gordo, com elevada concentração de n-3 LC-PUFA (Aha, 2015).
Dentre os peixes marinhos, o salmão do Atlântico (Salmo salar L.) é o principal representante dos peixes gordos com alta concentração de n-3 LC-PUFA. A cadeia alimentar marinha desses peixes é formada por seres ricos em n3, como o EPA e o DHA e por essa razão, grande parte dos peixes marinhos perderam a capacidade de elongamento e dessaturação de ácidos graxos.
Esses peixes quando cultivados em viveiros, são tradicionalmente alimentados com uma dieta com óleo de peixe, derivados de espécies pelágicas.
Com o aumento da população mundial ocorreu concomitantemente um aumento de demanda por pescado. Como a pesca por captura encontra-se estagnada e com tendência a diminuir, cada vez mais a aquiculturauma maior proporção de peixes destinados ao mercado deve vir por peixes cultivados (Jackson e Shepherd, 2012; OECD-FAO, 2013).
Sendo assim, com a expansão da piscicultura e do consumo de peixe, ocorre um aumento na demanda por insumos destinados à alimentação de organismos aquáticos.
Apesar dos benefícios do óleo de peixe, o preço elevado do produto tem se tornado um fator limitante para o desenvolvimento sustentável da indústria da aquicultura.
Atualmente, os óleos vegetais são considerados uma alternativa sustentável para substituição de óleo de peixe em rações para a aquicultura devido ao
- Aumento constante da produção,
- Alta disponibilidade e
- Preços mais estáveis.
Entretanto, os peixes de água doce, de uma forma geral, possuem uma série de enzimas com a capacidade de promover o alongamento e seguindo uma dessaturação dos ácidos graxos das séries n3 e n6 consumidos levam a produção de ácidos graxos poli-insaturados de cadeia longa (Zheng et al., 2004).
A partir do ácido linoleico (Al, 18:2n-6) convertem em araquidônico (20:4n−6, ARA) e o ácido linolênico (18:3n-3, ALN) em ácido eicosapentaenoico (20:5n-3, EPA), e finalmente para ácido docosahexaenóico (22:6n−3, DHA) (Sargent et al., 2002) (Figura 2).
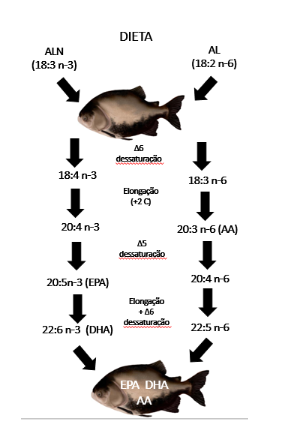
Figura 2- Bioconversão de ALN e AL, em EPA, DHA e AA pelas enzimas elongases e dessaturases.
Fonte: Adaptado de Souza et al. (2007)
Dentre as espécies que possui essa capacidade biossintética, podemos destacar:
- A tilápia do Nilo (Tocher et al., 2001) e
- o tambaqui, espécies mais produzidas em nosso país.
Estudos sobre a substituição do óleo de peixe como fonte lipídica em dieta por alguns recursos alternativos são interessantes para o desenvolvimento sustentável para a nutrição aquícola (Rombenso et al., 2016), sem influenciar o desempenho dos animais e a qualidade da carne.
A utilização de óleos vegetais tem sido uma boa alternativa, como:
- Óleo de girassol,
- Óleo de linhaça,
- Óleo de soja,
- Óleo de canola e
- Óleo de milho,
Podendo ser utilizados para substituir o óleo de peixe (YUE e SHEN, 2021).
A ração dos peixes de cativeiro exerce função determinante em sua composição lipídica, uma vez que, caso seja rica em PUFA n-3, favorece a síntese de EPA e DHA do peixe, melhorando a qualidade de carne.
Muitos estudos nutricionais vêm sendo realizados com o objetivo de aumentar os níveis de ácidos graxos de cadeia longa poli-insaturados com a manipulação de dietas contendo diferentes tipos de óleo ou usando dietas com altos níveis de ácido linoleico entre outros (Hsiehet al., 2007).
Segundo Souza et al. (2007), mais estudos sobre a alimentação dos peixes bem como a capacidade que cada espécie possui em bioconverter PUFA em ácidos graxos altamente insaturados deveriam ser realizados.
Assim, poderia ser viabilizado o aumento na quantidade de EPA e DHA nos peixes de cativeiro, garantindo maiores benefícios à saúde dos consumidores.
Considerações finais
Através da manipulação da dieta das espécies criadas em cativeiro, os peixes de água doce se tornam uma opção para a saúde humana, uma vez se podemos melhorar a qualidade da carne, utilizando uma dieta com fontes de óleo vegetal, enriquecendo-a com EPA e DHA.
Referências Bibliográficas
AHA, 2015. The American Heart Association’s Diet and Lifestyle Recommendations.
HSIEH, S.L., HU, C.Y., HSU, Y.T., HSIEH, T.J. Influence of dietary lipids on the fatty acid composition and stearoyl-CoA desaturase expression in hybrid tilapia..Comparative Biochemistry and Physiology. Part B: Biochemistry & Molecular Biology 147 (3), 438–444, 2007.
JACKSON, A.J., SHEPHERD, C.J. The future of fishmeal and fish oil. In: Ryder, J.,Ababouch, L., Balaban, M. (Eds.), Second International Congress on Seafood Technology on Sustainable, Innovative and Healthy Seafood FAO Fisheries and Aquaculture Proceedings. No. 22. Food and Agriculture Organisation, Rome, p. 238, 2012.
LI, Y., MONROIG, Ó., ZHANG, L., WANG, S., ZHENG, X., DICK, J.R., YOU, C., OECD/Food and Agriculture Organization of the United Nations, 2013. OECD-FAO Agricultural Outlook 2013.
ROMBENSO, A.N.; TRUSHENSKI, J.T.; SCHWARZ, M.H. Fish oil replacement in feeds for juvenile Florida pompano: composition of alternative lipid influences degree of tissue fatty acid profile distortion. Aquaculture, v. 458, p.177–186, 2016.
SARGENT, J.R.; TOCHER, D.; BELL, J. G. The lipids. Pages 181-257. In J.E. Halver, and R.W. Hardy, Fish nutrition. Academic Press, Amsterdam, AM, The Netherlands, 2002.
SOUZA, N. E; MATSUSHITA, M. DE OLIVEIRA, C. C. et al. Manipulation of fatty acid composition of Nile tilapia (Oreochromis niloticus) fillets with flaxseed oil. J Sci Food Agric 87:1677–1681, 2007.
TOCHER D.R.; AGABA M.;HASTINGS N.; BELL J.G.; DICK J.R.; TEALE, A.J. Nutritional regulation of hepatocyte fatty acid desaturation and polyunsaturated fatty acid composition in zebrafish (Danio rerio) and tilapia (Oreochromis niloticus). Fish Physiology and Biochemistry, Volume 24, Issue 4, pp 309–320, 2001.
TOCHER, D.R. Fatty acid requirements in ontogeny of marine and freshwater fish. Aquacult. Res. 41, 717–732, 2010.
TOCHER, D.R. Vertebrate fatty acyl desaturase with Δ4 activity. Proc. Natl. Acad. Sci. U. S. A. 107, 16840–16845, 2010.
YUE, K.; SHEN, Y. Uma visão geral das tecnologias disruptivas para a aquicultura. Aquaculture and Fisheries, 2021.
ZHENG, X. et al. Characterization and comparison of fatty acyl Delta desaturase cDNAs from freshwater and marine teleost fish species. Comparative biochemistry and physiology. Part B, Biochemistry & molecular biology, v. 139, n. 2, p. 269-79, 2004.
[/registrados]
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar esta publicação e muito mais conteúdo especializado. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em nutriNews
REGISTRE-SE
















