A crescente produção na cadeia avícola demanda diariamente a formulação de rações que atendam às necessidades dos animais, considerando o menor custo, já que a ração representa valores que podem chegar a 70% do custo de produção.
⇒ Desta forma, a utilização de grãos com grandes variações qualitativas gera a necessidade de constantes correções e inclusões de aditivos, o que impacta financeiramente o processo produtivo.
⇒ Além disso, é necessário o controle de fatores antinutricionais e contaminantes que podem prejudicar o desenvolvimento das aves e comprometer a qualidade intestinal.
Em termos de produção, a avaliação da qualidade física dos grãos está relacionada à sua integridade, quanto às condições de conservação, como:
- Grãos ardidos
- Grãos Chochos
- Grãos Carunchados
- Presença de micotoxinas
- Densidade específica
Com relação às variáveis químicas e bromatológicas, os principais parâmetros avaliados são: Umidade Fibra bruta Proteína bruta Extrato etéreo Presença de micotoxinas Aflatoxinas e fumonisinas
- Umidade
- Fibra bruta
- Proteína bruta
- Extrato etéreo
- Presença de micotoxinas
- Aflatoxinas e fumonisinas
Estas variáveis são influenciadas pela cultivar do milho e pelas práticas desde o plantio até a armazenagem dos grãos, que podem impactar negativamente em termos nutricionais.
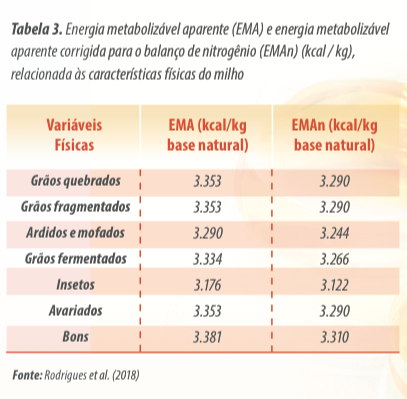
Por exemplo, a realização de colheita em condições climáticas desfavoráveis leva à necessidade de secagem, provocando reduções no conteúdo de energia metabolizável, que podem chegar até 300kcal/kg (Carvalho et al., 2004).
O incorreto armazenamento dos grãos de milho facilita a infestação de insetos, que se alimentam de amido e parte do gérmen do milho, reduzindo os valores de energia bruta, com menor densidade especifica dos grãos e alterações nos níveis de proteína bruta e fibra bruta (Lopes et al., 1988).
Para fins de recebimento ou não de determinada carga de milho em uma fábrica de ração, deve-se realizar a coleta de, no mínimo, 2,0 kg por ponto amostrado, de maneira homogênea pelo caminhão e alcançando o terço superior, o meio e o terço inferior da carga.
O número de amostras coletadas dependerá do tamanho da carga, variando entre 3 a 11 pontos.
Ainda de acordo com esta normativa, os grãos de milho ideais devem chegar à fábrica de ração fisiologicamente bem desenvolvidos, limpos e secos, apresentando percentual máximo de umidade de 14% (MAPA, 2011).
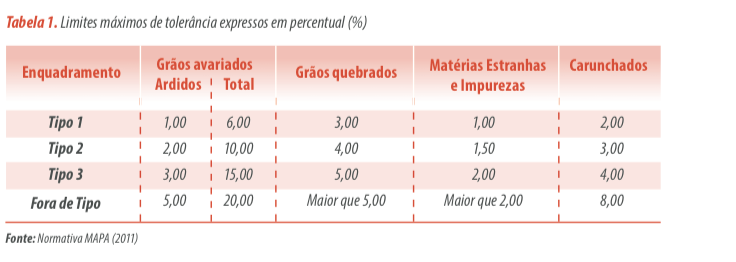



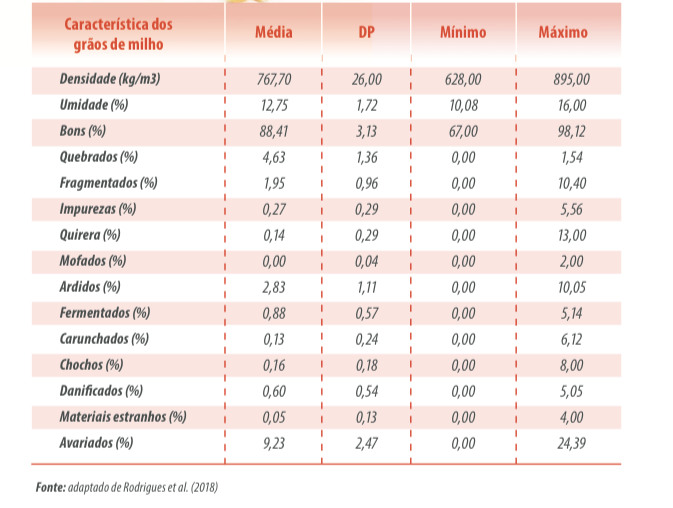
Por consequência de sua classificação dentro das diferentes características propostas acima, os grãos apresentam variação nos valores nutritivos em relação aos normais, especialmente em virtude da presença de insetos, fungos, micotoxinas e de fatores anti-nutricionais.
O armazenamento de milho com teores de umidade acima do considerado ideal (12-13%) propicia a proliferação de fungos (Mantovani et al., 2015), principalmente dos gêneros Alternaria, Cladosporium, Fusarium, Helmintosporium, Aspergillus e Penicillium (Puzzi, 1986).
Outro fator preocupante se refere à contaminação múltipla dos grãos de milho.
Raj et al. (2020) avaliaram a contaminação de grãos de milho colhidos no Brasil por cromatografia liquida por espectrometria de massa, e os percentuais de grãos sem detecção de micotoxinas foi de 9%, com uma micotoxina, também, foi de 9% e em 82% das amostras analisadas foram identificadas mais que uma micotoxina.
É importante que essa identificação seja feita e a utilização de antifúngicos no processo de armazenamento seja considerada pelos armazenadores e fábricas de ração.
Stringhini et al. (2000) relataram que a presença de micotoxinas na dieta das aves ocasionou alterações metabólicas, fisiológicas e anatomopatológicas nos animais, comprometendo órgãos como o intestino, a moela e o fígado, embora não tenham encontrado alteração no desempenho das aves em decorrência da atuação dessas toxinas.
Contudo, os autores observaram aumento na ocorrência de problemas locomotores nos frangos.
Já na avaliação realizada por Rauber et al. (2013), os autores observaram no fígado, nos rins e no intestino delgado, com impacto na conversão alimentar de frangos de corte em decorrência da presença de Fumonisina na ração.
Reforça-se, assim, a necessidade de se avaliar, além das características físicas e dos valores nutricionais e energéticos, a presença desses contaminantes, que podem ser determinantes nos resultados produtivos.
A adoção de medidas de mitigação desses efeitos negativos pode ser realizada com adsorventes de micotoxinas.
Para melhorar a precisão das estimativas dos valores nutricionais e da qualidade das dietas, é de suma importância a realização de análise física e química do ingrediente, no momento da chegada da matéria prima na fábrica.
⇒ Além das medidas de qualidade física, como a separação da diferentes frações e classificação dos grãos, como já informado acima, com as análises bromatológicas, é possível obter os teores de:
- Matéria orgânica (MO)
- Matéria seca (MS)
- Extrato etéreo (EE)
- Proteína bruta (PB)
- Fibra em detergente neutro (FDN)
- Fibra em detergente ácido (FDA)
- Matéria mineral (MM)
- Cálcio (Ca)
- Fósforo (P)
- Sódio (Na)
- Potássio (K)
- Magnésio (Mg)

Mas, é possível utilizar metodologias que permitam, de forma simples e rápida, determinar e/ou predizer a qualidade nutricional dos ingredientes a serem selecionados para composição da dieta, tornando-se uma importante aliada dos nutricionistas que formulam dietas para animais monogástricos.
Com a estimativa da qualidade nutricional do ingrediente, é possível definir os nutrientes limitantes da dieta e com isso corrigir os déficits nutricionais a partir de outras estratégias, como, por exemplo, a suplementação com aminoácidos sintéticos e enzimas exógenas (Gonçalves et al., 2018).
Entre as técnicas já desenvolvidas, além da análise bromatológica tradicional, destaca-se o uso da espectroscopia da reflectância na região do infravermelho próximo (NIRS).
Neste tipo de análise, o resultado é obtido rapidamente e não há necessidade do uso reagentes químicos. Ressalta-se que as curvas de estimativa desses valores pelo NIRS devem ser atualizadas constantemente, utilizando os valores nutricionais embasados em dados bromatológicos, obtidos com frequência por via úmida. Esse dinamismo da avaliação nutricional é necessário para que se permita a atualização dos dados dos ingredientes.
O controle de micotoxinas e das variáveis que acarretam no seu aparecimento deve ser rigoroso devido ao elevado poder contaminantes, que consequentemente levará a perdas em eficiência de produtividade na indústria.
Deve-se observar a correta amostragem para reduzir a variabilidade na detecção de micotoxinas. Conforme sugerido por Mallmann et al. (2018), orienta-se a aumentar o volume e o número de pontos amostrados ou reduzir o tamanho de partícula na moagem para homogeneização.
Técnicas de avaliação tradicional têm sido aplicadas na detecção desses compostos, como HPLC e ELISA, que oferecem medidas importantes para a identificação das micotoxinas presentes no milho e outros ingredientes das dietas. A identificação desses compostos em equipamentos NIRS tem sido desenvolvida no sentido de agilizar a identificação desses compostos, o que pode apoiar de forma clara a decisão da utilização dos ingredientes mais adequados para a formulação de rações (Mallmann e Tyska, 2019). Mas, é importante que as técnicas tradicionais sejam mantidas em sistemas de produção, visto que os sistemas NIRS dependem destes dados para a elaboração e atualização das curvas de detecção.
A avaliação da qualidade do milho, independente da metodologia empregada, sempre será fundamental na utilização desta matéria prima para ração de aves.
É importante estabelecer procedimentos para se obter grãos de milho que atendam a todos os principais requisitos de qualidade, nunca perdendo de vista, as melhoras nos procedimentos de colheita, transporte, armazenamento e destinação.
Percebe-se que esses procedimentos vêm sendo fortemente trabalhados e melhorados ao longo dos anos, e isso tem trazido resultados satisfatórios na produção de ração para frangos de corte.
O estabelecimento de um programa de monitoria dos dados físicos, químicos e a identificação das micotoxinas é essencial para se garantir a qualidade das dietas, o rendimento econômico da produção e a saúde dos animais.
Para melhorar a precisão das estimativas dos valores nutricionais e da qualidade das dietas, é de suma importância a realização de análise física e química do ingrediente, no momento da chegada da matéria prima na fábrica.
Além das medidas de qualidade física, como a separação da diferentes frações e classificação dos grãos, como já informado acima, com as análises bromatológicas, é possível obter os teores de: Matéria orgânica (MO) Matéria seca (MS) Extrato etéreo (EE) Proteína bruta (PB) Fibra em detergente neutro (FDN) Fibra em detergente ácido (FDA) Matéria mineral (MM) Cálcio (Ca) Fósforo (P) Sódio (Na) Potássio (K) Magnésio (Mg).
E de posse dessas informações, pode-se estimar a composição em energia a partir de equações de predição descritas pelas Tabelas Brasileiras para Aves e Suínos a fração energética de cada insumo, principalmente do milho (Rostagno et al., 2017), e também com as equações propostas por (Rodrigues et al., 2018).
Referencial Teórico
Batista, L.F. (2016). Avaliação nutricional da qualidade do milho para frangos de corte. Dissertação de Mestrado em Zootecnia. Universidade Federal de Goiás – GO.
Carvalho, D.C.O., Albino, L.F.T., Rostagno, H.S., Oliveira, J.E., Vargas Junior, J.G., Toledo, R. S., Costa, C.M.R., Pinheiro, S.R.F., Souza, R.M. (2004). Composição química e energéticas de amostras de milho submetidas a diferentes temperaturas de secagem e períodos de armazenamento. Revista Brasileira de Zootecnia, v. 33, n. 2, p. 358-364.
Gonçalves, J.L., Fernandes, A.M.F., Sousa, R.T., Santos, S.F. (2018). Utilização do NIRS na determinação dos parâmetros de digestibilidade e consumo em ruminantes. Nutritime Revista Eletrônica, on-line, Viçosa, v.15, n.04, p.8200-8253.
Lopes, D.C., Fontes, R.A., Donzele, J.L., Alvarenga, J.C. (1988). Perda de peso e mudanças na composição química do milho (Zea mays, L.) devido ao carunchamento. Revista da Sociedade Brasileira de Zootecnia, Viçosa, v. 17, n.4, p. 367-371.
Mantovani, E.C. et al. (2015). Cultivo do milho. Embrapa Milho e Sorgo.
Mallmann, C. A.; Vasconcelos, T. G.; Tyska, D. e Martins, A. C. (2018). Comparação de metodologias analíticas e de amostragem para micotoxinas. Disponível em: https://www.lamic.ufsm.br/site/publicacoes/category/1-aflatoxinas#, acessado em 21 de junho de 2020.
Mallmann. A.O. e Tyska, D. (2020) Gerenciamento do Risco Micotoxinas através da tecnologia NIR. Disponível em: https://pt.engormix.com/micotoxinas/artigos/gerenciamento-risco-micotoxinas-atraves-t44268.htm 1/7. Acessado em 21 de junho de 2020.
MAPA. Instrução Normativa n° 60, de 22 de dezembro de 2011.
Puzzi, D. (1986). Abastecimento e armazenagem de grãos, Campinas-SP: Instituto Campineiro de Ensino Agrícola. 603p.
Rauber, R.H.; Oliveira, M.S., Mallmann, A.O., Dilkin, P.; Mallmann, C.A.; Giacomini, L.Z.e Nascimento, V.P. (2013). Effects of fumonisin B1 on selected biological responses and performance of broiler chickens. Pesquisa Veterinária Brasileira, v.33, n.9; p.1081-1086.
Raj, J., Farkaš, H., Jakovčević, Z., Todorović, N., Bošnjak-Neumüller, J., Vasiljevi, M. (2020). Múltiples Micotoxinas Detectadas en el Maíz cosechado 2019. PATENT CO,. Mišićevo, Serbia.
Ribeiro, C.L.N., Barreto, S.L.T., Hannas, M.I. (2015). Micotoxinas encontradas em rações e alimentos utilizados na produção comercial de aves no Brasil. Artigo 292 Volume 12 – Número 01– p. 3910– 3924- Janeiro/Fevereiro 2015.
Rodrigues, S.I.F.C., Stringhini, J.H., Tanure, C.B., Peripolli, V., Seixas, L., McManus, C. (2018). Prediction of apparent metabolizable energy and metabolizable energy corrected for nitrogen of corn according to physical classification of the grain. Revista Brasileira de Zootecnia, 47:e20170153.
Rostagno, H.S.; Albino, L.F.T.; Donzele, J.L.; Gomes, P.C.; Oliveira, R.F.; Lopes, D.C.; Ferreira, A.S.; Barret, S.L.T. (2017). Tabelas brasileiras para aves e suínos – composição e alimentos e exigências nutricionais. 3. ed. p. 252. Viçosa: Universidade Federal de Viçosa.
Souza, M.L.M., Sulyok, M., Costa, S.S., Krska, R., Schuhmacher, R. (2008). Determinação simultânea de micotoxinas em milho e ração no Brasil por cromatografia líquida de alta eficiência e espectrometria de massas. Revista Ciências da Vida. Seropédica, RJ, EDUR, v. 28. https://ainfo.cnptia.embrapa.br/digital/bitstream/item/65819/1/2009-094.pdf
Stringhini J.H., Mogyca N.S., Andrade M.M.A., Orsine G.F, Café M.B., Borges, S.A. (2000). Efeito da qualidade do milho no desempenho de frangos de corte. Revista Brasileira de Zootecnia, v.29, p. 191-198.
Stuth, J., Jama, A., Tolleson, D. (2003) Direct and indirect means of predicting forage quality trough near infrared reflectance spectroscopy. Field Crops Research, v.84, p.45-56
Por: José Henrique Stringhini, Deibity Alves Cordeiro, Carla Daniela Suguimoto Leite, Laura Alves Duarte, Lucas Brito de Castro, Imar Crisógno Fernandes Filho | Departamento de Zootecnia – Escola de Veterinária e Zootecnia da Universidade Federal de Goiás
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar esta publicação e muito mais conteúdo especializado. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em nutriNews
REGISTRE-SE












