La permeabilidad del tracto intestinal controla la absorción de nutrientes y el transporte de sustancias extracelulares no deseadas como bacterias y xenobióticos, además de las sustancias no digeridas. Por lo tanto, la salud intestinal juega un papel esencial en la patogenia de diversos trastornos intestinales.
ALTERACIÓN EN LA MICROBIOTA INTESTINAL
En condiciones normales, la relación simbiótica entre la microbiota intestinal y el huésped determina de manera crucial la salud intestinal. Sin embargo, una alteración en la microbiota intestinal puede conducir a una relación huésped-microbio desequilibrada, lo que se denomina “disbiosis”.
![]() Varios factores pueden alterar la microbiota intestinal como los factores antinutricionales en los alimentos, los metales pesados, las sustancias tóxicas, las toxinas bacterianas, los herbicidas y los antibióticos.
Varios factores pueden alterar la microbiota intestinal como los factores antinutricionales en los alimentos, los metales pesados, las sustancias tóxicas, las toxinas bacterianas, los herbicidas y los antibióticos.
![]() Estos impactos pueden provocar inflamación localizada, infección extensa o incluso intoxicación.
Estos impactos pueden provocar inflamación localizada, infección extensa o incluso intoxicación.
![]() Además, el epitelio intestinal forma conexiones estrechas que actúan como una barrera biológica que controla el tránsito paracelular de diferentes materiales a través del epitelio intestinal, incluidos iones, solutos y agua.
Además, el epitelio intestinal forma conexiones estrechas que actúan como una barrera biológica que controla el tránsito paracelular de diferentes materiales a través del epitelio intestinal, incluidos iones, solutos y agua.
![]() También funciona como una barrera de bacterias extracelulares, antígenos y xenobióticos.
También funciona como una barrera de bacterias extracelulares, antígenos y xenobióticos.
 BARRERA INTESTINAL DETERIORADA
BARRERA INTESTINAL DETERIORADA
La función de la barrera intestinal deteriorada, comúnmente conocida como “intestino permeable”, es una condición en la que el revestimiento del intestino delgado se daña, lo que lleva a la infiltración de contenidos luminales, como bacterias y sus componentes asociados, incluidas las toxinas, para pasar entre las células epiteliales.
| Estas condiciones conducen posteriormente a daño celular y/o inflamación del intestino, que se caracteriza por un aumento de los niveles de endotoxinas derivadas de bacterias en la sangre.  Este proceso inflamatorio consume cantidades significativas de nutrientes y, posteriormente, tiene efectos negativos sobre las respuestas metabólicas, en particular sobre las respuestas Este proceso inflamatorio consume cantidades significativas de nutrientes y, posteriormente, tiene efectos negativos sobre las respuestas metabólicas, en particular sobre las respuestasinmunometabólicas y endocrinas.   Como resultado, el desempeño de los animales se reduce severamente. Como resultado, el desempeño de los animales se reduce severamente. |
Además, las observaciones de campo en Europa mostraron que la industria avícola enfrentó varios problemas después de la prohibición de los antibióticos promotores del crecimiento (AGP, por sus siglas en inglés), incluyendo los impactos negativos en el rendimiento, los aspectos del bienestar animal y los problemas generales de salud.
 En respuesta a la prohibición de AGP, varias alternativas a los antibióticos, como probióticos, prebióticos y sustancias fitogénicas, se han desarrollado, probado, evaluado y utilizado para la producción de pollos y pavos con una frecuencia cada vez mayor. En respuesta a la prohibición de AGP, varias alternativas a los antibióticos, como probióticos, prebióticos y sustancias fitogénicas, se han desarrollado, probado, evaluado y utilizado para la producción de pollos y pavos con una frecuencia cada vez mayor.
En esta revisión, discutimos el papel de estas alternativas en el mantenimiento de la función intestinal a través de la modulación de la microbiota intestinal y los efectosrelacionados que benefician la salud y la calidad de las aves. |

MICROBIOTA INTESTINAL EN AVES DE CORRAL
Los microorganismos que viven en el tracto gastrointestinal (GIT) de los animales son un excelente ejemplo de bacterias beneficiosas. De hecho, el GIT es el hogar de una comunidad microbiana diversa y abundante que brinda funciones esenciales a sus animales huéspedes.
![]() Impacto en el desarrollo y funcionamiento
Impacto en el desarrollo y funcionamiento
Aunque el intestino está expuesto a los componentes de la microflora desde el nacimiento o la eclosión, se sabe poco sobre su impacto en el desarrollo y funcionamiento saludables.
![]() Los microorganismos están más densamente poblados en el GIT que en cualquier otro órgano.
Los microorganismos están más densamente poblados en el GIT que en cualquier otro órgano.
![]() Los animales han desarrollado la capacidad de albergar consorcios complejos y dinámicos de microbios a lo largo de su ciclo de vida durante millones de años de evolución.
Los animales han desarrollado la capacidad de albergar consorcios complejos y dinámicos de microbios a lo largo de su ciclo de vida durante millones de años de evolución.
![]() Como resultado, se requiere una comprensión detallada de las contribuciones de estas comunidades microbianas autóctonas al desarrollo del huésped y la fisiología de los adultos para una comprensión completa de la biología de los vertebrados.
Como resultado, se requiere una comprensión detallada de las contribuciones de estas comunidades microbianas autóctonas al desarrollo del huésped y la fisiología de los adultos para una comprensión completa de la biología de los vertebrados.
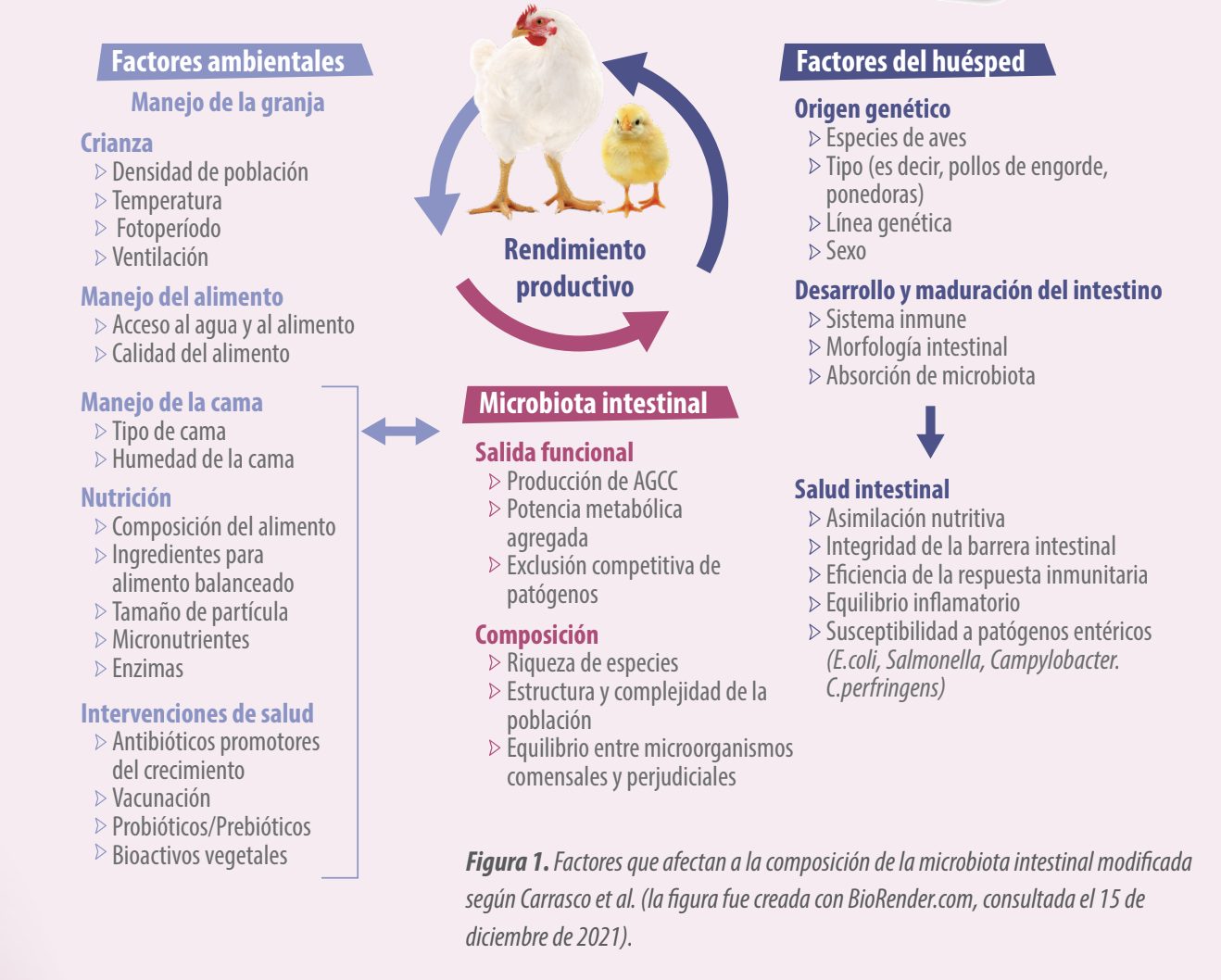
![]() Las especies animales, la raza, la edad, la nutrición, el medio ambiente, las formas de crianza, la densidad de población, el estrés y los medicamentos pueden tener un impacto en la delicada composición de la microbiota intestinal. Los factores que afectan la composición de la microbiota intestinal se muestran en la Figura 1.
Las especies animales, la raza, la edad, la nutrición, el medio ambiente, las formas de crianza, la densidad de población, el estrés y los medicamentos pueden tener un impacto en la delicada composición de la microbiota intestinal. Los factores que afectan la composición de la microbiota intestinal se muestran en la Figura 1.
La colonización de los intestinos de las aves ya podría comenzar durante la embriogénesis y progresar hasta la formación de una sociedad microbiana compleja y dinámica. |
![]() Con base en los principios establecidos durante la historia animal, es probable que las interacciones microbianas-microbianas y microbioana-huésped extensivas y combinatorias gobiernen el ensamblaje de la microbiota.
Con base en los principios establecidos durante la historia animal, es probable que las interacciones microbianas-microbianas y microbioana-huésped extensivas y combinatorias gobiernen el ensamblaje de la microbiota.
 Al comparar roedores libres de gérmenes que se criaron sin exposición a microorganismos con aquellos que desarrollaron una microbiota desde el nacimiento, o aquellos que fueron colonizados con componentes de la microbiota durante o después del desarrollo posnatal, se identificó una variedad de funciones del huésped influenciadas por las comunidades microbianas autóctonas. Al comparar roedores libres de gérmenes que se criaron sin exposición a microorganismos con aquellos que desarrollaron una microbiota desde el nacimiento, o aquellos que fueron colonizados con componentes de la microbiota durante o después del desarrollo posnatal, se identificó una variedad de funciones del huésped influenciadas por las comunidades microbianas autóctonas. |
La microbiota, por ejemplo:
- Dirige la formación de tejido linfoide asociado al intestino.
- Ayuda a la educación del sistema inmunitario.
- Afecta la integridad de la barrera de la mucosa intestinal.
- Modula la proliferación y diferenciación de linajes epiteliales.
- Regula la angiogénesis.
- Modifica la actividad del sistema nervioso entérico.
- Desempeña un papel crítico en la extracción y procesamiento de los nutrientes consumidos.
Además, las proteínas y los productos de degradación de proteínas, las y las glicoproteínas endógenas o extrañas pueden ser metabolizadas por la microflora.
![]() Incluso, algunas bacterias se alimentan de productos de fermentación bacteriana o productos intermedios, incluidos H2, lactato, succinato, formato y etanol, y los convierten en productos finales que nuevamente se secretan a la luz intestinal, como los ácidos grasos de cadena corta (AGCC), un proceso que tiene un impacto directo en la fisiología intestinal.
Incluso, algunas bacterias se alimentan de productos de fermentación bacteriana o productos intermedios, incluidos H2, lactato, succinato, formato y etanol, y los convierten en productos finales que nuevamente se secretan a la luz intestinal, como los ácidos grasos de cadena corta (AGCC), un proceso que tiene un impacto directo en la fisiología intestinal.
 Más del 90% de todas las especies de microbiota intestinal en humanos y animales pertenecen a los filos Bacteroidetes, Firmicutes y Actinobacteria, otras son Fusobacteria, Proteobacteria, Verrucomicrobia y Cyanobacteria. Más del 90% de todas las especies de microbiota intestinal en humanos y animales pertenecen a los filos Bacteroidetes, Firmicutes y Actinobacteria, otras son Fusobacteria, Proteobacteria, Verrucomicrobia y Cyanobacteria.
En pollos, los filos Bacteroidetes y Firmicutes son los representantes más predominantes en el intestino. En humanos y varios animales, la relación entre Firmicutes y Bacteroidetes es un marcador asociado con la salud/metabolismo.
|
![]() Nutracéuticos
Nutracéuticos
También se supone que los principios moleculares que ayudan a modificar y mantener el funcionamiento fisiológico normal de la microbiota intestinal se derivan principalmente de los alimentos y sus suplementos, como los nutracéuticos.
Los nutracéuticos pueden incluir todo:
- Nutrientes aislados (vitaminas, minerales, aminoácidos, ácidos grasos);
- Productos herbales (polifenoles, hierbas, especias);
- Suplementos dietéticos (probióticos, prebióticos, simbióticos, ácidos orgánicos, antioxidantes, enzimas);
- Alimentos modificados genéticamente
Estos nutracéuticos también ayudan en la prevención de enfermedades infecciosas del huésped.
Además, han surgido varias bacterias resistentes a múltiples fármacos, lo que ha hecho que esta crisis sea global. Se requerirán nutracéuticos para reducir el uso de antibióticos.
![]() Bacterias del ácido láctico
Bacterias del ácido láctico
Las bacterias del ácido láctico se han utilizado como suplementos alimenticios desde tiempos precristianos cuando los humanos ingirieron leche fermentada.
Metchnikoff y sus colaboradores identificaron de la leche en mal estado el ‘bacilo búlgaro’, muy probablemente Lactobacillus bulgaricus, que se empleó en ensayos posteriores. |
 Hoy en día, este microorganismo se conoce como Lactobacillus delbrueckii subspecies bulgaricus, que es una de las bacterias que se utiliza para fermentar la leche y hacer yogur. Tras la muerte de Metchnikoff en 1916, el foco de trabajo en este campo se desplazó a los Estados Unidos. Hoy en día, este microorganismo se conoce como Lactobacillus delbrueckii subspecies bulgaricus, que es una de las bacterias que se utiliza para fermentar la leche y hacer yogur. Tras la muerte de Metchnikoff en 1916, el foco de trabajo en este campo se desplazó a los Estados Unidos.
|
Los avances en bacteriología y la disponibilidad más fácil de animales libres de gérmenes ayudaron a evaluar el impacto de los ocupantes intestinales recientemente identificados en el huésped.
Con base en estos estudios, quedó claro que Lactobacillus acidophilus no era el único Lactobacillus en el intestino, y se examinó una variedad de otras especies y finalmente se incluyeron en formulaciones probióticas.
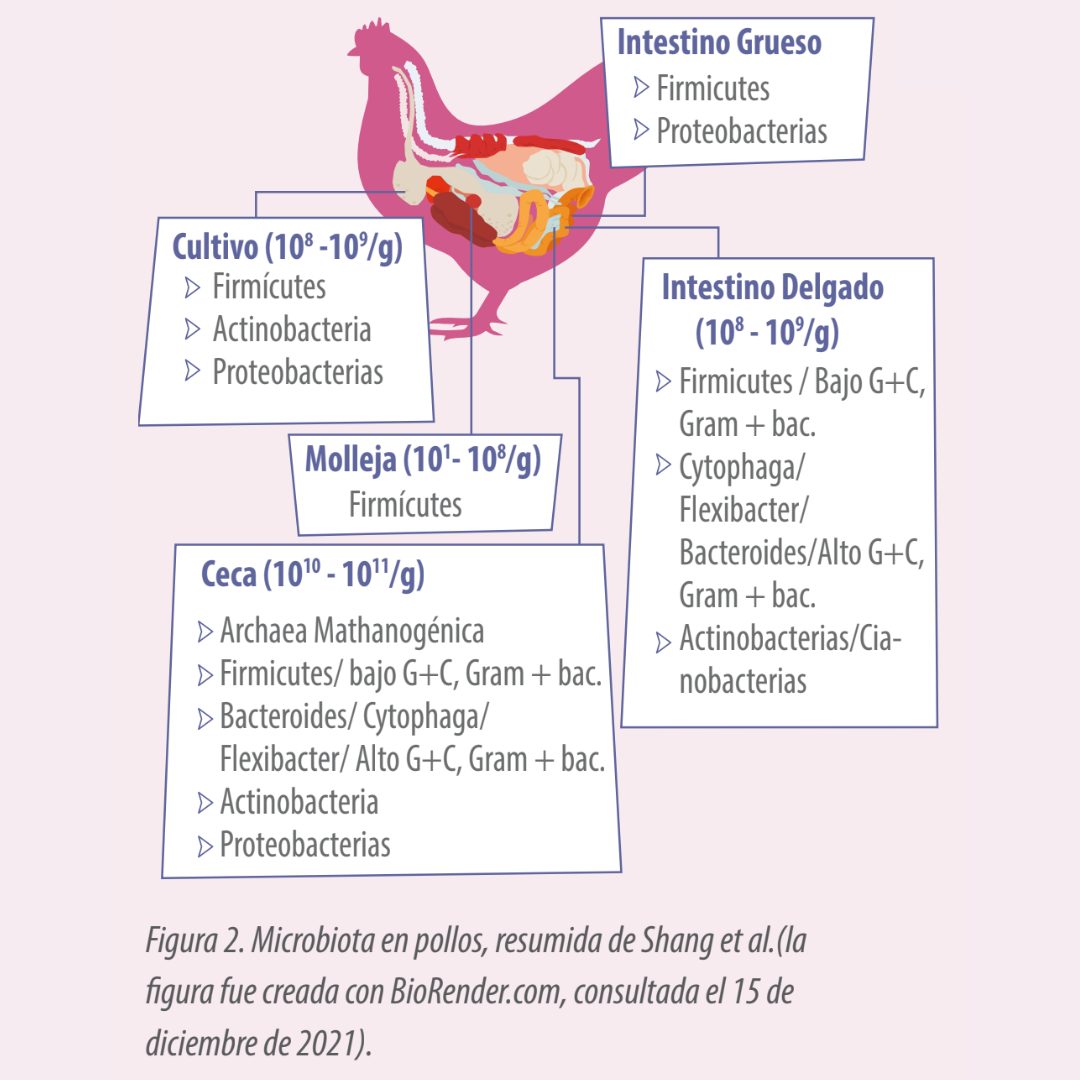
Los principales representantes de la microbiota intestinal de los pollos se resumen en la Figura 2. Comprender cómo madura y se desarrolla el intestino en los pollos y cómo los suplementos alimenticios benefician el rendimiento intestinal aumentará la eficiencia alimenticia, el crecimiento y la salud en general.
![]() Barrera intestinal y uniones estrechas
Barrera intestinal y uniones estrechas
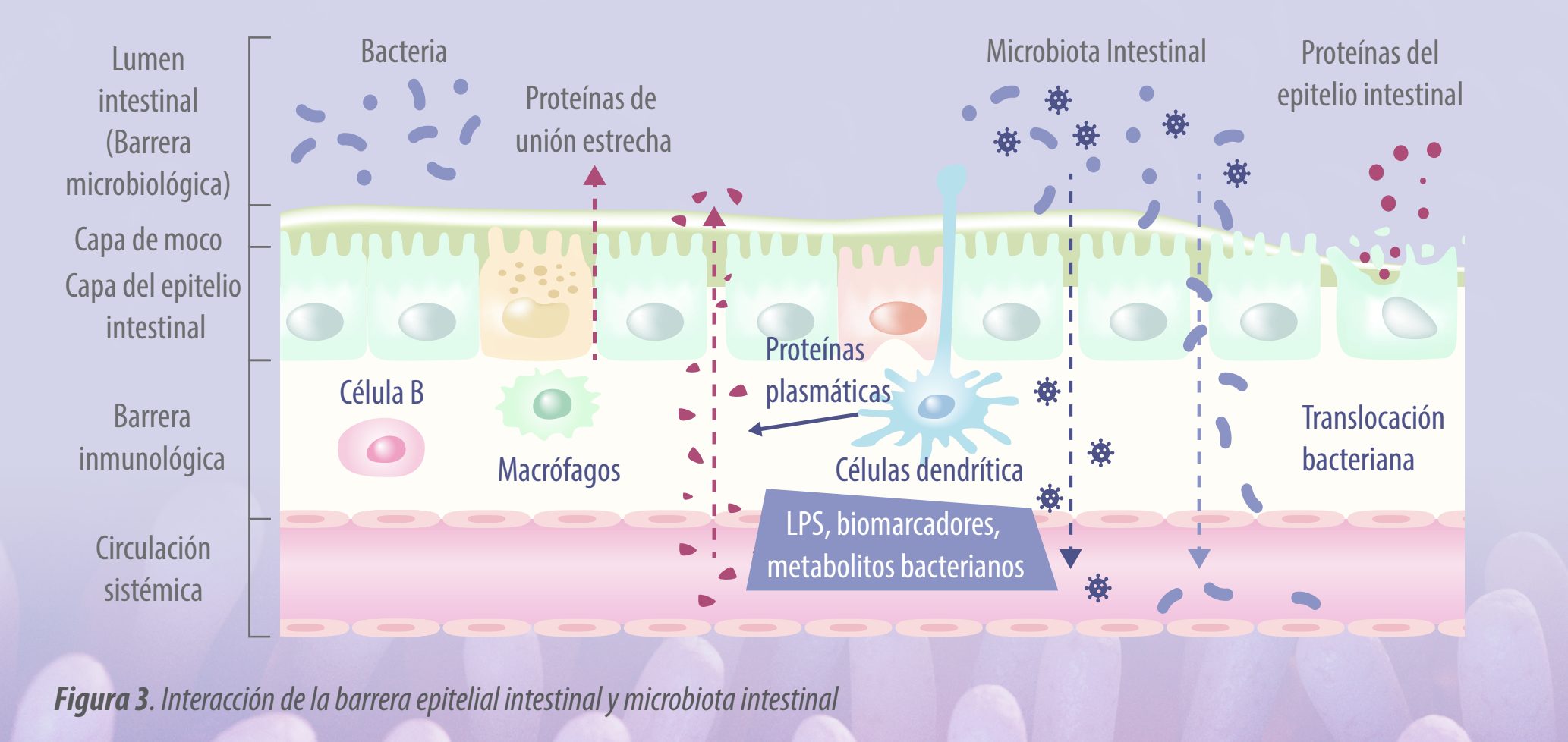
Los enterocitos son la piedra angular de la monocapa de la mucosa intestinal que protege al huésped del ambiente externo. En la Figura 3 se muestra un esquema de la barrera epitelial intestinal y algunas interacciones con la microbiota intestinal.
| Los enterocitos están conectados por las llamadas uniones estrechas (TJ), que constituyen un cinturón continuo de contactos íntimos formados durante el proceso de ensamblaje de las transmembranas integrales (ocludina, claudinas, moléculas de adhesión de unión (JAM) y tricelulina) y membranas periféricas (zonula occludens-1 (ZO-1), ZO-2 y ZO-3).
Las proteínas de las TJ se ubican entre enterocitos adyacentes, sellando el espacio paracelular y regulando la permeabilidad de la barrera intestinal. |
Por tanto, estas proteínas impiden el tránsito de microorganismos, toxinas y otros antígenos desde la luz intestinal hacia la circulación sistémica.
| La formación y función de las uniones estrechas están controladas por vías de transducción de señales intracelulares: · Señalización de proteína quinasa C (PKC), A (PKA) y G (PKG), · Fosfatasa-Rho, cadena ligera de miosina (MLC) quinasa (MLCK), señalización de MAPK y · El fosfatidilinositol 3 kinasa (PI3K/Akt). |
En tanto, la interrupción de las uniones estrechas por factores bacterianos puede ocurrir en los siguientes pasos:
· El lipopolisacárido bacteriano (LPS) activa las células epiteliales intestinales y los macrófagos;
· Estas células secretan citoquinas proinflamatorias como IL-1ß; y
· La IL-1ß activa aún más estas células y desencadena la señalización intracelular, como p38 MAP quinasa, que posteriormente activa MLCK. F
 Finalmente, estos procesos conducen a un aumento de la permeabilidad intestinal. Por lo tanto, el síndrome del intestino permeable se desarrolla como una respuesta a los patógenos, la privación de alimento y el estrés.
Finalmente, estos procesos conducen a un aumento de la permeabilidad intestinal. Por lo tanto, el síndrome del intestino permeable se desarrolla como una respuesta a los patógenos, la privación de alimento y el estrés.
BIOMARCADORES RELACIONADOS CON LA SALUD INTESTINAL DE LOS ANIMALES
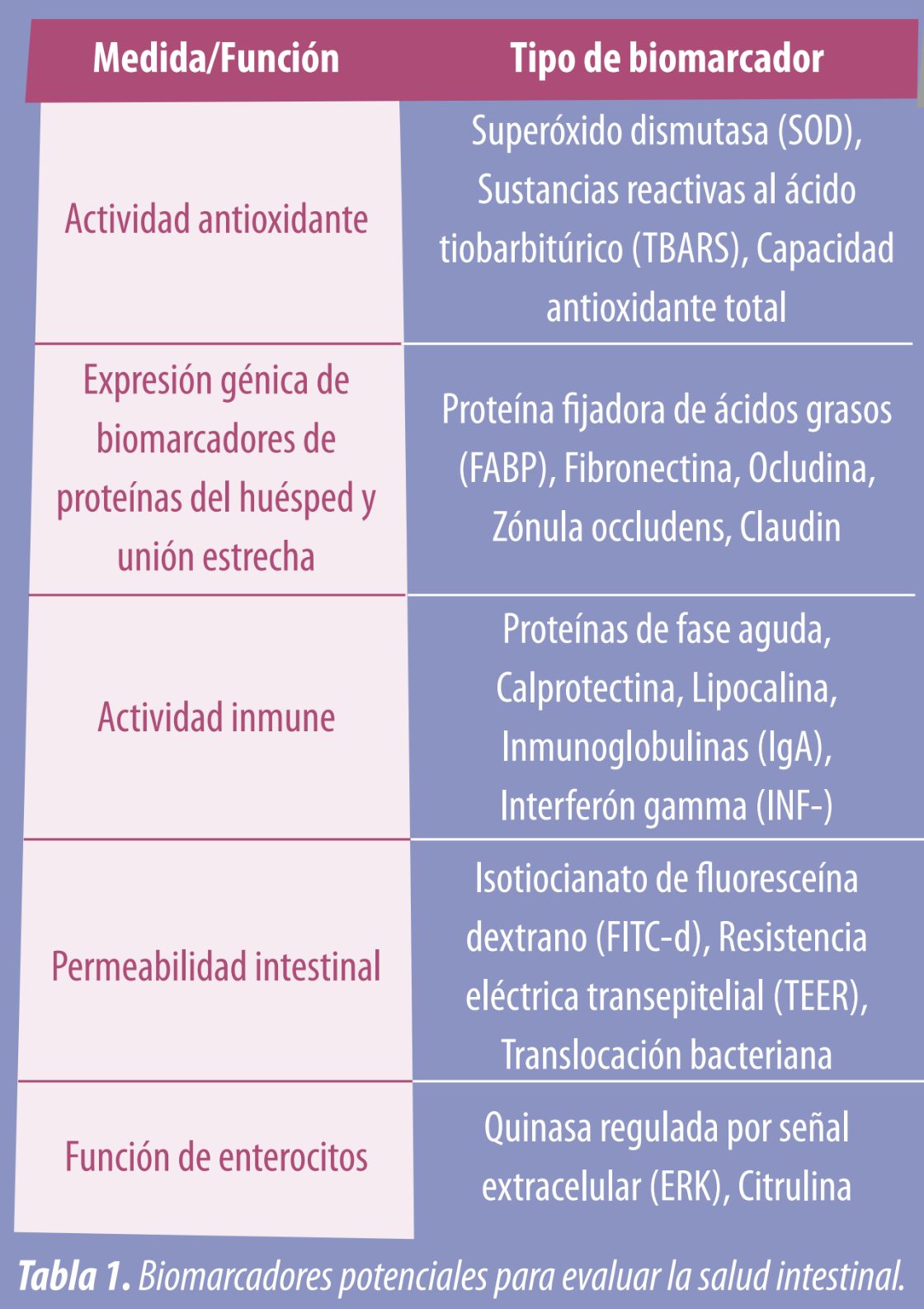
![]() Las interacciones entre la función de barrera epitelial, la inflamación intestinal y el entorno microbiano influyen en la salud intestinal. Por lo tanto, el descubrimiento de biomarcadores confiables y generalizados para medir la inflamación intestinal y la función de barrera es un área importante de investigación en curso. En la Tabla 1 se presenta un resumen de algunos de los biomarcadores conocidos relacionados con la salud intestinal.
Las interacciones entre la función de barrera epitelial, la inflamación intestinal y el entorno microbiano influyen en la salud intestinal. Por lo tanto, el descubrimiento de biomarcadores confiables y generalizados para medir la inflamación intestinal y la función de barrera es un área importante de investigación en curso. En la Tabla 1 se presenta un resumen de algunos de los biomarcadores conocidos relacionados con la salud intestinal.
| Para estudiar la salud intestinal, también es importante desarrollar modelos intestinales inflamatorios con diferentes condiciones de desafío (factores antinutricionales, patógenos, toxinas y desencadenantes ambientales). |
La inflamación también puede estar asociada con el estrés oxidativo y cambios en la expresión de genes relacionados con el estrés oxidativo, lo que indica que el estrés oxidativo puede tener un papel fundamental en la función intestinal fisiológica.
| Una técnica cuantitativa que se utiliza para evaluar la integridad de las proteínas de las uniones estrechas en las monocapas de células epiteliales es la medición de la resistencia eléctrica transepitelial (TEER). La respiración mitocondrial es necesaria para mantener la TEER, lo que implica que la oxidación juega un papel fundamental en la estabilidad de las uniones estrechas de las células Caco-2. |
Según Janssen-Duijghuijsen et al., la producción reducida de adenosín trifosfato(ATP) mitocondrial resultó en una disminución de la permeabilidad intestinal y un aumento en la expresión de los genes de ocludina y claudina-1, pero una disminución en la expresión de los genes de claudina-2 y claudina-7.
 En consecuencia, se estableció una conexión directa entre la función mitocondrial, el estado energético celular y la integridad intestinal.
En consecuencia, se estableció una conexión directa entre la función mitocondrial, el estado energético celular y la integridad intestinal.
A menudo, el estrés oxidativo se cuantifica examinando los metabolitos formados durante o después de un proceso oxidativo.
Otros biomarcadores que se podrían ocupar para medir la actividad antioxidante incluyen sustancias reactivas al ácido tiobarbitúrico (TBARS), que son metabolitos formados durante la peroxidación; capacidad antioxidante total; y el ensayo de Griess, que utiliza la descomposición de nitritos y nitratos para determinar la concentración de óxido nítrico dentro de la célula. |
![]() Biomarcador de función intestinal
Biomarcador de función intestinal
Los biomarcadores para la evaluación de la salud intestinal también pueden estar relacionados con el seguimiento de la función intestinal.
 La citrulina es un subproducto nitrogenado del metabolismo de la glutamina que se puede convertir en arginina y se produce principalmente en los enterocitos del intestino delgado. La citrulina es un subproducto nitrogenado del metabolismo de la glutamina que se puede convertir en arginina y se produce principalmente en los enterocitos del intestino delgado.
Los niveles de citrulina en plasma se han asociado con la absorción intestinal de marcadores como el manitol en lechones antes del destete, lo que indica que la citrulina se puede utilizar para controlar la función intestinal.
Por lo tanto, la actividad de ERK en suero puede reflejar la alteración intestinal causada por un factor estresante.
|
 Biomarcadores relacionados con la actividad inmunitaria
Biomarcadores relacionados con la actividad inmunitaria
En el caso de los biomarcadores relacionados con la actividad inmunitaria que pueden influir en la salud intestinal.
 La IgA secretora (SIgA) es un componente crítico del sistema inmunitario humoral y la principal inmunoglobulina que interactúa con patógenos en la superficie de la mucosa. En consecuencia, tiene una estrecha relación con la homeostasis del medio intestinal.
La IgA secretora (SIgA) es un componente crítico del sistema inmunitario humoral y la principal inmunoglobulina que interactúa con patógenos en la superficie de la mucosa. En consecuencia, tiene una estrecha relación con la homeostasis del medio intestinal.
Una citocina proinflamatoria con propiedades inmunoestimuladoras e inmunomoduladoras es el interferón-gamma (INF-γ).
![]() Esta citocina se ha relacionado con la endocitosis de proteínas de unión estrecha. Por lo tanto, tiene un impacto factible en la permeabilidad intestinal.
Esta citocina se ha relacionado con la endocitosis de proteínas de unión estrecha. Por lo tanto, tiene un impacto factible en la permeabilidad intestinal.
En última instancia, es probable que tanto las respuestas inmunitarias innatas como las adaptativas proporcionen biomarcadores viables para evaluar la salud intestinal.
 Análisis histomorfológico Análisis histomorfológico
El análisis histomorfológico es otro tipo de evaluación muy influenciada por un adecuado equilibrio del medio intestinal.
|
 Biomarcadores de permeabilidad intestinal
Biomarcadores de permeabilidad intestinal
La translocación bacteriana y la expresión génica de las TJ, como claudinas, ocludinas y zonula occludens (ZO-1), son biomarcadores de permeabilidad intestinal que se utilizan para evaluar la salud intestinal.
La translocación bacteriana se ha relacionado con enfermedades como la condronecrosis con osteomielitis en pollos de engorde y reproductoras. Lo que sugiere la migración de patógenos entéricos a las vértebras torácicas.
 Se ha demostrado que las TJ como la ocludina están reguladas a la baja en pacientes humanos con enfermedades inflamatorias del intestino (enfermedad de Crohn) y en pollos bajo condiciones de desafío de salud intestinal nutricional, lo que revela el papel fundamental de las TJ como la ocludina en el mantenimiento de la integridad de la barrera intestinal. Se ha demostrado que las TJ como la ocludina están reguladas a la baja en pacientes humanos con enfermedades inflamatorias del intestino (enfermedad de Crohn) y en pollos bajo condiciones de desafío de salud intestinal nutricional, lo que revela el papel fundamental de las TJ como la ocludina en el mantenimiento de la integridad de la barrera intestinal. |
Un conjunto diferente de biomarcadores candidatos incluyen las proteínas de unión a ácidos grasos (FABP), que son chaperonas de lípidos intracelulares a cargo de orquestar el metabolismo de los lípidos y las vías críticas sensibles a los lípidos en macrófagos y adipocitos.
![]() La FABP2 ha sido estudiada en humanos y en pollos, mostrando una respuesta de regulación a la baja cuando hay una lesión en la barrera intestinal.
La FABP2 ha sido estudiada en humanos y en pollos, mostrando una respuesta de regulación a la baja cuando hay una lesión en la barrera intestinal.
Otro biomarcador bien conocido que se ha utilizado en aves de corral para evaluar la permeabilidad intestinal es la medición del dextrano de isotiocianato de fluoresceína (FITC-d) en el suero.

| Algunos biomarcadores no invasivos que actualmente están siendo estudiados en muestras fecales por diferentes grupos de investigación son la fibronectina, la calprotectina y la lipocalina. Estos candidatos a biomarcadores han mostrado resultados prometedores en pollos; sin embargo, también ha existido inconsistencias entre los estudios.
|
Si te gustó este contenido, te recomendamos que leas: Factores nutricionales & microbiota intestinal en porcino.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en nutriNews
REGISTRARME




 Una enzima antioxidante que desintoxica los subproductos metabólicos dañinos y que generalmente se mide como un biomarcador es la superóxido dismutasa (SOD).
Una enzima antioxidante que desintoxica los subproductos metabólicos dañinos y que generalmente se mide como un biomarcador es la superóxido dismutasa (SOD).








