 28 Feb 2022
28 Feb 2022
La acidosis ruminal continúa siendo un trastorno digestivo común en el ganado de carne y puede conducir a reducciones marcadas en el rendimiento del ganado.
Esta enfermedad refleja un desequilibrio entre la producción microbiana de ácidos grasos volátiles (AGV) y la absorción ruminal de éstos.
![]() Los cambios microbianos en la acidosis subaguda se asemejan a los observados durante la adaptación a la alimentación con granos. La disminución de la población de protozoos ciliados es una característica común de ambas formas de acidosis y puede ser un buen indicador microbiano de un rumen acidótico. Se cree que otros factores microbianos, como la presencia de endotoxinas y la histamina, contribuyen a los efectos sistémicos de la acidosis.
Los cambios microbianos en la acidosis subaguda se asemejan a los observados durante la adaptación a la alimentación con granos. La disminución de la población de protozoos ciliados es una característica común de ambas formas de acidosis y puede ser un buen indicador microbiano de un rumen acidótico. Se cree que otros factores microbianos, como la presencia de endotoxinas y la histamina, contribuyen a los efectos sistémicos de la acidosis.
 El reticulo-rumen es un ecosistema anaeróbico en el que la digestión microbiana de los alimentos convierte a los sustratos fermentables principalmente en ácidos orgánicos, que luego se absorben en su mayoría.
El reticulo-rumen es un ecosistema anaeróbico en el que la digestión microbiana de los alimentos convierte a los sustratos fermentables principalmente en ácidos orgánicos, que luego se absorben en su mayoría.
Mientras la disponibilidad de sustrato no sea excesiva y la tasa de absorción se mantenga a la altura de la producción, la fermentación ruminal es estable y el pH ruminal a menudo se encuentra en el rango de 5,8 a 6,5 en el ganado adaptado al grano.
El pH ruminal fluctúa considerablemente en un período de 24 horas y está influenciado por:

En el ganado de carne alimentado con dietas altamente concentradas, la capacidad del animal para amortiguar el rumen está limitada por una secreción salival inadecuada. Si la capacidad de absorción de la pared ruminal se ve afectada por papilas ruminales anormales o rumenitis, la posibilidad del animal para mantener un pH ruminal estable se ve afectada.
El pH ruminal es un factor crítico en la función normal y estable del rumen debido a su profundo efecto sobre las poblaciones microbianas y los productos de fermentación, y sobre las funciones fisiológicas del rumen, principalmente la motilidad y la función de absorción.
![]() Cuando el pH ruminal cae por debajo de 5,6 se da un cambio en las poblaciones microbianas hacia la producción de ácido láctico, lo que reduce aún más el pH ruminal.
Cuando el pH ruminal cae por debajo de 5,6 se da un cambio en las poblaciones microbianas hacia la producción de ácido láctico, lo que reduce aún más el pH ruminal.
[registrados]
En la Figura 1 se muestra un ejemplo de patrón de pH ruminal diurno monitoreado continuamente durante un período de 2 días en un novillo alimentado con una dieta concentrada al 92,5% basada en grano de maíz una vez al día (Cooper et al., 1998).
Figura 1. pH ruminal durante un período de 48 h de un novillo adaptado a una dieta de concentrado al 92,5 % a base de maíz triturado alimentado una vez al día.
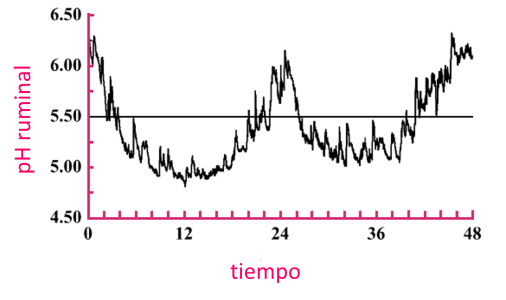
El pH ruminal se monitoreó con un electrodo de pH sumergible suspendido a través del tapón de la cánula ruminal y se registró
cada minuto (datos de Cooper et al., 1998).
Lo que no se conoce es el tiempo mínimo de pH subóptimo necesario para tener un efecto perjudicial sobre la actividad microbiana, la digestión de nutrientes y la función ruminal.
Al evaluar la importancia del pH ruminal, es importante considerar no solo el pH promedio, sino también las fluctuaciones posprandiales, particularmente la duración del pH subóptimo (<5,6).
 La concentración total de AGV generalmente aumenta al inicio de la acidosis, pero con la progresión de la misma, las concentraciones de AGV disminuyen drásticamente debido a la destrucción de la flora bacteriana normal y la dilución ruminal por la entrada de líquidos para compensar el aumento de la osmolalidad.
La concentración total de AGV generalmente aumenta al inicio de la acidosis, pero con la progresión de la misma, las concentraciones de AGV disminuyen drásticamente debido a la destrucción de la flora bacteriana normal y la dilución ruminal por la entrada de líquidos para compensar el aumento de la osmolalidad.
El aumento de la producción de ácido láctico se debe esencialmente al establecimiento de una población de lactobacilos tolerantes a los ácidos, y la disminución de la fermentación se debe a que el pH está por debajo del rango necesario para que las bacterias fermentadoras de lactato estén activas.
![]() Esto no ocurre en la acidosis subaguda, donde el ácido láctico no se acumula porque las bacterias fermentadoras de lactato permanecen activas y lo metabolizan rápidamente.
Esto no ocurre en la acidosis subaguda, donde el ácido láctico no se acumula porque las bacterias fermentadoras de lactato permanecen activas y lo metabolizan rápidamente.
Aunque los ácidos ruminales se consideran los principales contribuyentes a la fisiopatología de la acidosis, se ha implicado a otros factores como:
La concentración ruminal de etanol (principalmente un producto de lactobacilos heterofermentativos) aumenta en condiciones acidóticas, pero no es lo suficientemente alta como para ser significativa. Además, los microorganismos del rumen son capaces de metabolizar el etanol. Se cree que las aminas y las endotoxinas bacterianas tienen un papel en la patogenia de la acidosis.
Las aminas farmacológicamente activas, como la histamina, la tiramina y la triptamina, se producen en el rumen por descarboxilación del precursor AA. Entre las 3 aminas, la histamina ha recibido una atención considerable debido a su papel en la laminitis, ya que es un potente vasodilatador y aumenta la permeabilidad capilar.
La endotoxina o lipopolisacárido (LPS) es un componente de la pared celular de todas las bacterias gram-negativas, independientemente de su patogenicidad. Se ha demostrado que las bacterias ruminales mixtas contienen LPS endotóxicos.
Algunas investigaciones también sugieren que las bacterias gram-positivas producen bacteriocinas contra una amplia variedad de bacterias, incluidas las gram-negativas (Martinez et al., 2013).
Según Zhao et al. (2018), la expresión y producción del factor de necrosis tumoral-α, la interleucina-1ß (IL-1ß) y la IL-6 aumentaron en el epitelio del rumen debido a la alta concentración de LPS en el rumen, y estas podrían ser una de las razones para animales que experimentan rumenitis mientras cursan con acidosis subaguada.
Figura 1. Estructura de la pared celular de bacterias Gram negativas con énfasis en la presencia de lipopolisacáridos (LPS) en la membrana externa.
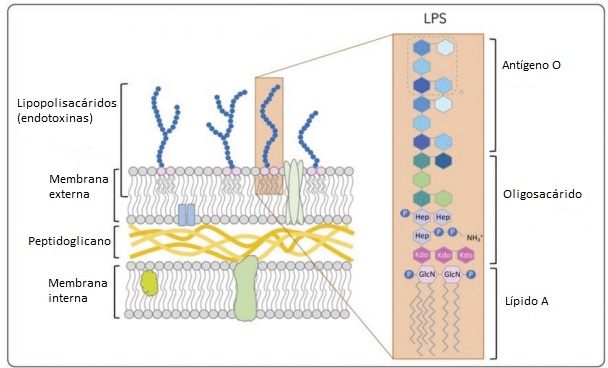
La toxicidad se asocia principalmente con la composición del lípido A.
Adaptado de Yen-Ming Hsu, AB Biosciences, Inc. Boston, Massachusetts, EE. UU.
Junto con un aumento de la concentración de LPS, los estudios han demostrado que los animales con acidosis subaguda tienen una riqueza y diversidad reducidas tanto en bacterias ruminales como fecales (Mao et al., 2013; Plaizier et al., 2017)
En el rumen, el género Bifidobacterium es un importante productor de ácido láctico en el rumen y su población aumenta durante la acidosis tanto sub como aguda (Plaizier et al., 2017a). Además, éste género produce la mayoría de las bacteriocinas contra las bacterias Gram-positivas y Gram-negativas, suprimiendo el crecimiento bacteriano.
Curiosamente, las dietas con mayor contenido de granos también aumentan la tasa de paso de la digesta fuera del rumen y permiten que sustratos más fermentables lleguen al intestino posterior (Van Soest, 1994). El aumento de la fermentación del grano en el intestino posterior puede causar efectos similares a la acidosis ruminal, lo que aumenta el daño epitelial y puede permitir la entrada de LPS a la circulación (Gressley et al., 2011).
Las bacterias productoras de ácido láctico (LAB), específicamente Streptococcus bovis, fermentan rápidamente almidón y glucosa para producir lactato en el rumen (Nocek, 1997), alcanzando un tiempo de duplicación de tan solo unos minutos. El lactato comienza a acumularse porque las bacterias que lo utilizan lactato, particularmente Megasphaera elsdenii y S. ruminantium, se replican lentamente y tardan semanas en aumentar considerablemente su población en el rumen (Russell y Rychlik, 2001).
![]() En consecuencia, el lactato se acumula rápidamente y reducen aún más el pH ruminal (pH<5,0).
En consecuencia, el lactato se acumula rápidamente y reducen aún más el pH ruminal (pH<5,0).

Las revisiones anteriores sobre acidosis ruminal han enfatizado la importancia de la adaptación de los animales a dietas altas en concentrados (Owens et al., 1998; Nagaraja y Titgemeyer, 2007).
Si bien los protocolos de intensificación son costosos, eventualmente pueden diluir los efectos de los endotoxinas debido a los cambios microbianos, lo que ocurre al reducir la lisis bacteriana Gram-negativa debido a un cambio menos abrupto de los sustratos bacterianos o por los efectos diluidos de la toxicidad de LPS bacteriano.
Conclusión
La acidosis provoca una disbiosis en el microbioma ruminal, y algunas bacterias Gram negativas disminuyen su número en el rumen y aumenta la lisis de estas bacterias, como lo indica el aumento de LPS libre.
Otros estudios muestran que además del aumento de LPS en el rumen durante este tiempo, este incremento también podría desencadenar el crecimiento de bacterias ruminales asociadas con la acidosis.
Por lo tanto, se deben realizar estudios futuros para caracterizar el LPS ruminal y su estructura de lípido A para determinar con precisión su toxicidad y poder desarrollar más estrategias para superar este importante desafío en la nutrición de los rumiantes♦
Fuentes: Monteiro y Faciola, 2020
[/registrados]
Suscríbete ahora a la revista técnica de nutrición animal
AUTORES

Achaparramiento del maíz: sus efectos sobre la calidad nutricional
Virginia Fain Binda
Harina zootécnica: Ficha de materia prima
Alba Cerisuelo
Efecto de Detoxa® Plus sobre los parámetros productivos en gallinas de postura
Cecilia Rodriguez
Optimizando el desempeño en situaciones de estrés
Horta Felipe
TechnoSpore: La cepa probiótica de Biochem que une lo mejor de dos mundos

El impacto de la suplementación de fibra dietética en lechones
Gustavo Cordero
Grasas oxidadas en porcinos: riesgos y consideraciones. Parte III
María Alejandra Pérez Alvarado
Proteína unicelular: alternativa sostenible a la proteína convencional
Meryem El Kissi
Nutrición de las terneras: Claves para asegurar el éxito. Parte II
José Luis Repetto
Carbohidratos para gatos ¿alternativa energética o enemigo silencioso? Parte II
Ada E. Lugo