CONCLUSIONES
Aditivos
Efectos de los β-galactomananos vegetales sobre la barrera intestinal
GUARDAR EN LA LIBRERÍA PDFPara leer más contenidos de NutriNews Junio 2016
Aditivos
Para leer más contenidos de NutriNews Junio 2016
El epitelio intestinal está expuesto a distintos componentes presentes en la luz del intestino, incluyendo toxinas, microorganismos y antígenos de distintos orígenes, entre otros.
La función barrera intestinal es la combinación de elementos que controlan el paso de macromoléculas o antígenos hacia el medio interno a través del epitelio intestinal, a la vez que permite el mantenimiento de las funciones fisiológicas (absorción de nutrientes, secreción, etc.) que garantizan la homeostasis.
Una adecuada función barrera evita por tanto el paso incontrolado de antígenos y microorganismos a través de los enterocitos, previniendo así un contacto excesivo con los componentes del sistema inmune entérico y la activación de respuestas inflamatorias, que tendrían un efecto negativo sobre la salud intestinal y la absorción de los nutrientes de la dieta.
La función barrera evita el paso incontrolado de antígenos y microorganismos a través de los enterocitos
» De este modo, la barrera intestinal constituye la primera línea de defensa del organismo y dificulta la instauración de patologías infecciosas que comprometen el estado sanitario de las explotaciones y empeoran los parámetros productivos

La función barrera intestinal está formada por distintos niveles de protección
Las uniones estrechas (TJ) son estructuras proteicas esenciales para el control de la función barrera epitelial del intestino. Estas estructuras regulan de forma precisa el paso de iones y macromoléculas a través del espacio paracelular, o espacio que existe entre los enterocitos.
Las uniones estrechas (TJ) son estructuras proteicas esenciales para el control de la función barrera epitelial del intestino
Las TJ están formadas por proteínas transcelulares como ocludina, claudinas y proteínas JAM, y por proteínas intracelulares como Zonula Occludens (ZO)-1, -2 y -3 (figura 1).
Estas últimas unen las proteínas transcelulares con un anillo de actomiosina del enterocito, que se contrae por acción de quinasas como la quinasa de la cadena ligera de la miosina MLCK, (del inglés, Myosin Light Chain Kinase), activada por diversos estímulos, y permitiendo así la apertura del espacio paracelular, causando un aumento de la permeabilidad del epitelio.

Figura 1. Esquema de las estructuras de unión intercelular y, en concreto, de las uniones estrechas (tight junctions)
Imagen de Aktories & Barbieri, 2005
Muchas enterobacterias patógenas causan disfunción de la barrera epitelial con el objetivo de facilitar la colonización intestinal
Determinadas cepas patógenas de Escherichia coli provocan la redistribución de ZO-1 y de los filamentos de actina del citoesqueleto, lo que causa una desestructuración de la TJ.
Salmonella typhimurium, además de causar cambios en la distribución de ZO-1, activa mecanismos para causar la contracción del polo apical de la célula (Brufau et al., 2015; Sears, 2000). Con ello, aumenta la permeabilidad del epitelio intestinal, facilitando la invasión por parte del patógeno y promoviendo estados de inflamación que pueden perpetuarse debido a un mayor contacto del sistema inmune con antígenos del contenido intestinal.
Esto causa un aumento de citoquinas proinflamatorias que, a su vez, tienen efectos negativos sobre la función barrera del epitelio intestinal, cerrando un círculo vicioso.
Desde la prohibición del uso de antibióticos como promotores de crecimiento en 2006 por parte de la Unión Europea, han ido surgiendo diferentes estrategias para promover la salud intestinal y, por tanto, conseguir un buen estatus sanitario de los animales y la mejora de los rendimientos productivos de los mismos.
De este modo, en los últimos años han aparecido aditivos de gran utilidad como los β-galactomananos vegetales hidrolizados (βGMH).
Éstos principalmente actúan bloqueando las fimbrias de enterobacterias, como las de Salmonella enterica y Escherichia coli enterotoxigénico (ETEC), que constituyen uno de sus principales mecanismos de adhesión al epitelio, necesario para su colonización (Sharon & Lis, 1993).

El modo de acción de βGMH ha sido estudiado por Badia et al. (2012), que realizaron una serie de estudios sobre cultivos de células intestinales en presencia y ausencia de Salmonella typhimurium (figura 2).
La presencia de los βGMH a 0,5 μg/mL inhibió de forma significativa la invasión de las células intestinales por la Salmonella en cerca del 60% respecto el control positivo. Con niveles de βGMH de 10 μg/mL la reducción fue de más del 70% (Badia, Brufau, et al., 2012).
Estos mismos autores también evaluaron el efecto de los βGMH en la capacidad de invasión intestinal de E. coli K88 (Badia, Zanello, et al., 2012) en células intestinales protegidas con distintas concentraciones de βGMH hasta 20 μg/mL.
Se observó una reducción de invasión celular de hasta el 80% debido a la presencia de adhesinas sensibles a la β-galactosa en E. coli (figura 3).
Brufau et al. (2015) demostraron en pollos que los βGMH en la dieta aumentaban la secreción de moco intestinal por parte de las células caliciformes, no sólo respecto a los animales inoculados con 108 UFC Salmonella enterica serovar Enteritidis, sino también respecto a los controles no inoculados.
Además, a través de microscopía electrónica, reportaron un mayor número de estas células caliciformes en aquellos animales que ingirieron βGMH en la dieta y una menor cantidad de bacterias adheridas al epitelio intestinal (figura 4).
Una capa de moco con un grosor mayor, promovida por la adición en la dieta de βGMH, podría dificultar que, tanto Salmonella spp., como otros patógenos, puedan adherirse al epitelio sin inducir cambios en la absorción de nutrientes y en los parámetros productivos de los animales de forma negativa (Brufau et al., 2015).
Esto facilitaría su eliminación a través de las heces, ya sin capacidad infectiva tras su unión a los βGMH, disminuyendo así el riesgo de infección.

Los β-galactomananos vegetales hidrolizados (βGMH) principalmente actúan bloqueando las fimbrias de enterobacterias

Figura 2. Porcentaje de Salmonella adherida a células epiteliales en presencia de β-galactomananos vegetales hidrolizados (SALMOSAN. Industrial Técnica Pecuaria, S.A.). Las letras distintas indican diferencias significativas (P < 0.05; n = 5). (Badia et al., 2012)
El bloqueo de las bacterias mediante βGMH promueve su eliminación en las heces sin capacidad infectiva

Figura 3. Porcentaje de ETEC
Figura 3. Porcentaje de ETEC – βGMH (mg/mL) adherida a c.lulas epiteliales en presencia de β-galactomananos vegetales hidrolizados (SALMOSAN. Industrial T.cnica Pecuaria, S.A.). Letras distintascindican diferencias significativas (P < 0.05; n = 5). (Badia et al., 2012)

Figura 4. Microscopía electrónica del intestino de pollos: NC, no inoculación; PC: inoculación con 108 UFC de Salmonella enterica serovar Enteritidis. SA: inoculadas con Salmonella Enteritidis y con 1g/kg de β-galactomananos vegetales hidrolizados (SALMOSAN. Industrial Técnica Pecuaria, S.A.). Todas las imágenes corresponden a íleo, excepto NC-B, SA-B, PC-C y PC-D, que corresponden a ciego. Las flechas negras indican bacterias adheridas al moco y a lamelipodios. Las flechas blancas señalan células caliciformes y la letra M indica células M. (Brufau et al., 2015)
Esta menor interacción patógeno-epitelio queda también evidenciada en este trabajo de Brufau et al.
En condiciones de infección por Salmonella spp., y también por otras especies, diversos autores han descrito un aumento en el número de células epiteliales M -microfold cells- (Frost, Bland, & Wallis, 1997; Jepson & Clark, 1998; Brufau et al., 2015).
Las células M son responsables del transporte de antígenos intestinales al tejido linfoide de la mucosa intestinal y, a su vez, del paso de Salmonella a través de la pared intestinal
Estas células M son responsables del transporte de antígenos intestinales al tejido linfoide de la mucosa intestinal (GALT) mediante lamelipodios, que son prolongaciones de la membrana celular vinculadas a procesos de captación de patógenos por parte de la célula.
Son también estas células M, las que contribuyen al paso de Salmonella a través de la pared intestinal tras adherirse mediante sus fimbrias.
Por tanto, el hecho de que los tejidos pertenecientes a animales que consumen βGMH muestren un menor número de células M en su epitelio, y una menor formación de lamelipodios, es indicativo de una menor interacción de Salmonella enterica con el epitelio intestinal (figura 3).
Por otro lado, tal y como hemos comentado, en condiciones de inflamación intestinal puede producirse una desestructuración de las uniones estrechas que compromete la integridad de la función barrera intestinal.
Brufau et al. (2015) comprobaron mediante microscopía confocal que los animales infectados con Salmonella enterica muestran una deslocalización de la proteína de unión estrecha ZO-1.
Sin embargo, los animales que consumen β-galactomananos previenen estos efectos de la Salmonella, mostrando una distribución de ZO-1 que coincide con la posición real de las TJ (figura 5).
Asimismo, los βGMH poseen efectos inmunomoduladores contra Salmonella typhimurium (Badia, Lizardo, Martínez, & Brufau, 2014; Badia, Brufau, et al., 2012), lo que contribuye de forma indirecta al mantenimiento de la función barrera intestinal.
En los trabajos de Badia et al. (2012 y 2014), el desafío de cultivos de células intestinales porcinas (IPI-2I) con Salmonella typhimurium induce un aumento en la expresión génica (mRNA) de citoquinas proinflamatorias (IL-6, IL-1α, TNFα and GM-CSF) y de quimiocinas (CXCL-2, -8 y -10, y CCL-2 y -20) por parte de las células epiteliales.

Figura 5. Imágenes de microscopía confocal con inmunolocalización de ZO-1 en íleo de pollo. NC, aves no inoculadas; PC, aves inoculadas; SA, aves inoculadas + 1 g/kg SALMOSAN (Industrial Técnica Pecuaria, S.A.). Cy: citosol. (Brufau et al., 2015)
La adición de βGMH en el medio no sólo previene la inflamación causada por la infección con Salmonella typhimurium, sino que también reduce la expresión de algunos de estos marcadores de inflamación y favorece la salud intestinal en condiciones basales en ausencia del patógeno (en la figura 6 se muestran dos ejemplos representativos).
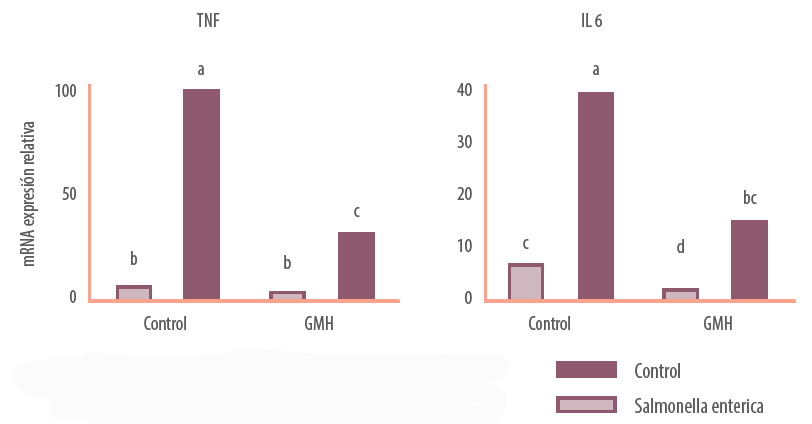
Figura 6. Efecto de los β-galactomananos vegetales hidrolizados (10 μg/ml. SALMOSAN. Industrial Técnica Pecuaria, S.A.) sobre la expresión de mRNA de citoquinas proinflamatorias (TNFα e IL6) en cultivo de células epiteliales intestinales cocultivadas con Salmonella. Letras distintas indican diferencias significativas (P < 0.05; n = 6) (Badia et al., 2012)
En cultivos de células dendríticas porcinas, Salmonella typhimurium también incrementa la expresión génica (mRNA) de determinadas citoquinas proinflamatorias (TNFα, IL-6 y GM-CSF) y antiinflamatorias (IL-10), así como de determinadas quimiocinas (CXCL8 y CCL17) (Badia et al., 2012).

A diferencia de lo que se observó en el caso de las células epiteliales, en presencia de la bacteria, el βGMH incrementó aún más la expresión de las citoquinas proinflamatorias TNFα y de GM-CSF, y de la antiinflamatoria IL-10 (P<0.05) por parte de las células dendríticas, sin variar la expresión de IL-6 o CCL17.
En ausencia de Salmonella typhimurium en el cultivo, el βGMH inducía la expresión de TNFα y GM-CSF, indicando así, junto a los resultados hallados en enterocitos porcinos (IPI-2I), que los βGMH podrían actuar per se como potenciales inmunomoduladores.
Recientes estudios en colaboración con el Departamento de Bioquímica y Fisiología de la Facultad de Farmacia y Ciencias de la Alimentación de la Universitat de Barcelona, publicado este año (J Nutr Biochem; 41: 20-24), demuestran que los efectos inmunomoduladores y sobre la función barrera intestinal de Salmosan se potencian con la incorporación de Lactobacillus plantarum.
En estas pruebas, se añadió lipopolisacárido (LPS) en co-cultivos Caco-2 – dTHP-1 para inducir la expresión de citoquinas inflamatorias y el deterioro de la función barrera. La incorporación de βGMH revirtió el aumento en la expresión de la citoquina inflamatoria TNFα y aumentó significativamente la expresión de la citoquina antiinflamatoria IL-10. Por sí sólo, la incorporación de Lactobacillus plantarum en el cultivo no indujo cambios significativos en la expresión de TNFα e IL-10, aunque sí en la de la citoquina con efectos antiinflamatorios IL-6.
La combinación de βGMH y Lactobacillus, además de los efectos sobre TNFα e IL-10, permitió obtener un aumento en la expresión de IL-6 y restaurar significativamente a niveles basales la función barrera intestinal evaluada mediante el registro de la resistencia eléctrica transepitelial (TER, del inglés transepithelial electric resistance). Este mismo efecto beneficioso sobre la permeabilidad del intestino fue confirmado también en cultivos celulares Caco-2 a los que se les indujo un aumento de la permeabilidad incorporando TNFα (figura 7), simulando un estado de inflamación.
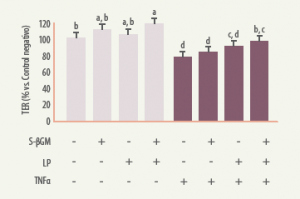
Figura 7. Efecto de los β-galactomananos vegetales hidrolizados (S-βGM, SALMOSAN. Industrial Técnica Pecuaria, S.A.) y de su combinación con Lactobacillus plantarum (LP) sobre la permeabilidad epitelial (TER: resistencia eléctrica transepitelial) en cultivos celulares Caco-2 en condiciones basales y de adición de TNFα en el medio. J Nutr Biochem. 2017; 41: 20-24.
Estos efectos sinérgicos entre βGMH y Lactobacillus, que no sólo se observan en condiciones de inflamación y deterioro de la función barrera epitelial, sino también en condiciones basales (figura 7), podrían deberse a un efecto positivo de estos polisacáridos sobre las bacterias ácidolácticas. De hecho, en este mismo artículo científico se refleja que la incorporación de βGMH en el medio de cultivo de Lactobacillus plantarum incrementa de manera significativa el recuento de estas bacterias probióticas (figura 8), confirmando así el efecto prebiótico de los βGMH.
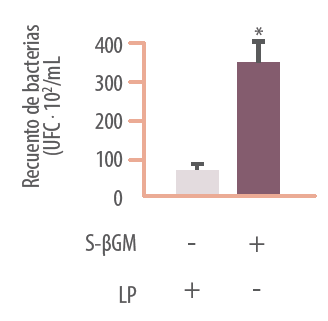
Figura 8. Efecto de los β-galactomananos vegetales hidrolizados (S-βGM, SALMOSAN. Industrial Técnica Pecuaria, S.A.) sobre el crecimiento de Lactobacillus plantarum (LP). J Nutr Biochem. 2017; 41: 20-24.
En condiciones in vivo, parte de los efectos sobre la función barrera intestinal podría deberse entonces a la modificación de la composición de la microbiota intestinal, promoviendo el crecimiento de bacterias beneficiosas, como las del género Lactobacillus, y bloqueando enterobacterias potencialmente patógenas como Salmonella y E. coli.
CONCLUSIONES
MÁS CONTENIDOS DE Itpsa