En los rumiantes, la mayoría de los procesos digestivos, especialmente la fermentación de carbohidratos y la degradación de las proteínas de la dieta, se deben a la microbiota ruminal: bacterias, protozoos, hongos y arqueas.
![]()
Esta microbiota simbiótica proporciona nutrientes al hospedador, especialmente ácidos grasos volátiles (AGV), proteína microbiana y vitaminas, aunque también se producen pérdidas de energía debido a la producción de metano.
A pesar de la alta estabilidad ruminal por su constancia funcional y la resiliencia del ecosistema microbiano (Weimer et al, 2015), la microbiota ruminal presenta grandes variaciones individuales (Jami y Mizrahi 2012) y puede verse alterada por cambios dietéticos abruptos o importantes, por ejemplo del contenido en almidón o grasa.

En la mayoría de las dietas de rumiantes, la grasa representa menos del 5% de la materia seca total siendo las semillas oleaginosas: semillas de lino, colza, soja y girasol la principal vía de inclusión de grasa en las dietas de rumiantes, ricas en ácidos grasos insaturados (AGI), incluyendo:
o ácido oleico (AOL, cis-9-C18: 1)
o ácido linoleico (AL)
o y ácido alfa-linolénico (ALA)
Los suplementos grasos se empezaron a usar para aumentar los valores energéticos de las dietas y cubrir las necesidades energéticas en las vacas lecheras o el ganado de engorde en sistemas intensivos, pero también se pueden utilizar para modificar el perfil de ácidos grasos (AG) de la carne (Wood et al., 2008) o de la leche, modulando sus propiedades dietéticas, organolépticas y tecnológicas.
La adición de grasa a la dieta puede:
– Modular la función del rumen, disminuyendo las emisiones de metano (Martin et al., 2016)
– Disminuir la ingesta y del contenido de grasa en la leche (Rabiee et al., 2012).
Un límite para la suplementación con grasas de las dietas de rumiantes es su efecto negativo sobre la degradabilidad ruminal, especialmente cuando tienen un alto contenido en AGI (Brooks et al., 1954).
En este trabajo vamos a centrarnos en la influencia de la grasa sobre la microbiota ruminal.
La mayoría de los AG de la dieta son ésteres de glicéridos:
- Triacilgliceroles, principalmente, en concentrados
- Galactolípidos y Fosfolípidos en el forraje, excepto en los ensilados en los que las lipasas vegetales liberan los ácidos grasos.
1er paso. Lipolisis
El primer paso del metabolismo ruminal de los acilgliceroles es la lipolisis, que da como resultado la liberación de los AG.
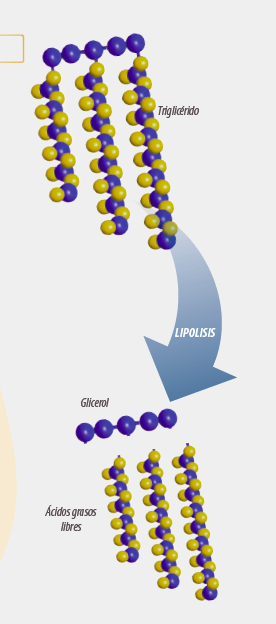
Lipolisis: acción de las lipasas sobre los enlaces éster que unen los ácidos grasos y los alcoholes que al ser hidrolizados liberan los ácidos grasos al medio (Esquema 1). Este proceso se lleva a cabo por las lipasas microbianas, aunque existe cierta actividad lipolítica en el propio material del vegetal.
2º paso . Adaptación detoxificante – biohidrogenación
La microbiota ruminal satura totalmente los AGI.
Este proceso se considera como una adaptación detoxificante (Kemp et al., 1984), y contribuye marginalmente a la eliminación de los equivalentes reductores producidos por la fermentación ruminal (Lourenço, et al. 2010).
Este proceso de biohidrogenación (BH) comprende varios pasos, dependiendo de los AGI, y varias vías, dependiendo de la dieta y el ambiente ruminal (Griinari et al., 1998).
• Los fosfolípidos y galactolípidos pueden ser hidrolizados por algunas cepas de Bacillus fibrisolvens (Hazlewood y Dawson 1979).
• Los triacilgliceroles también son hidrolizados por diferentes especies del grupo Butyrivibrio (Latham et al., 1972), pero la Anaereovibrio lipolyticus es la bacteria hidrolizadora de triglicéridos más conocida.
➢ La lipasa de la Anaereovibrio lipolyticus es fue estudiada por primera vez por Henderson (1971) y su genoma contiene tres genes que codifican lipasas (Prive et al., 2013).
➢ Las tres enzimas fueron más activas contra el láurico y el mirístico, que contra el palmítico o el esteárico, mientras que las grasas dietéticas contienen principalmente AG de 16 y 18 carbonos.
Los protozoos engloban bacterias, y la biohidrogenación bacteriana puede tener lugar dentro de los protozoos (Jenkins et al., 2008) y explicar sus altas concentraciones de productos intermediarios (Devillard et al., 2006).
Megasphera elsdenii YJ-4
Kim et al. (2002) aislaron una bacteria identificada como Megasphera elsdenii YJ-4 que produce trans-10, cis-12-CLA en el rumen con una dieta rica en almidón y encontraron que la cepa T81 también produce este isómero.
También se demostró que dos bacterias pertenecientes al género Fusocillus reducen C18:1 FA al ácido esteárico (Harfoot 1978).
Van de Vossenberg y Joblin (2003) aislaron una cepa de Butyrivibrio capaz de completar la BH tanto de AL como de ALA a ácido esteárico.
Wallace (2007) concluyó que las bacterias formadoras de ácido esteárico previamente identificados como Fusocillus sp. o Bacillus hungatei ocupan una rama específica del árbol Butyrivibrio.

Butyrivibrio
[registrados]
Estudios in vitro
Más allá de los estudios basados en los aislamientos seleccionados, se han realizado intentos para evaluar in vivo o in vitro la relación entre bacterias del rumen y la biohidrogenación (BH) agregando bacterias y midiendo sus productos, o agregando suplementos dietéticos que se sabe que afectan a la BH y medir la abundancia de bacterias.

Inoculando B. fibrisolvens en el rumen de cabras alimentadas con una dieta enriquecida con aceite alto en ácido linoléico (AL) aumentaron las concentraciones de ácido linoléico conjugado (CLA) total en el fluido del rumen, lo que confirma que esta bacteria está involucrada en la biohidrogenación in vivo (Shivani et al., 2016).
Debido a que la mayoría de las grasas dietéticas son glicéridos y necesitan sufrir una lipólisis antes de la BH, la disminución del metabolismo en el rumen de AG podría limitar la BH en el rumen.
➢ Un estudio preliminar con inhibidores de esterasa ha mostrado resultados prometedores in vitro (Sargolzehi et al., 2015).
➢ Apás et al. (2015) mostraron una mayor proporción de cis-9, trans-11-CLA en la leche de cabras suplementada con una mezcla de Lactobacillus, Bifidobacterium y Enterococcus.
➢ La grasa dietética da forma a la microbiota del rumen, Brooks et al (1954) demostraron que el aceite de maíz tanto in vitro como in vivo disminuye la degradación de la celulosa ruminal y la producción de AGV afectando la microbiota.
También encontraron que la manteca de cerdo, más saturada que el aceite de maíz, produce una disminución menor en la degradación de la celulosa.
➢ De manera similar, Ikwuegbu y Sutton (1982) encontraron una disminución de la degradabilidad de la fibra, del porcentaje de acetato y de butirato, y un aumento del propionato cuando se usó aceite de linaza.

Los extractos de plantas también podrían modular la actividad de las bacterias bio-hidrogenadoras.
➢ Los aceites esenciales disminuyeron o aumentaron (Ishlak et al., 2015) la abundancia de B. fibrisolvens in vitro, lo que podría explicar los cambios en el perfil de los productos de BH en el rumen (Lourenço, et al. 2010).
➢ De manera similar, los taninos disminuyeron las abundancia de B. proteoclasticus y aumentaron B. fibrisolvens (Ishlak et al., 2015) in vitro.
![]() Es conveniente señalar que la mayoría de los experimentos se realizaron con aceites, y que la mayoría de las cantidades experimentales excedieron la práctica común.
Es conveniente señalar que la mayoría de los experimentos se realizaron con aceites, y que la mayoría de las cantidades experimentales excedieron la práctica común.
En consecuencia, los resultados experimentales con respecto a los efectos de la grasa añadida sobre la microbiota y su actividad deben tomarse con precaución cuando se extrapolen a condiciones de campo.

En la segunda entrega, analizaremos los resultados que han obtenido los investigadores en los ensayos in vivo y detallaremos con más detenimiento la biohidrogenación de las grasas en el rumen, proceso que como ya vimos que es el paso posterior al primer proceso al que se ven sometidas las grasas que entran al rumen, la lipolisis.
[/registrados]
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en nutriNews
REGISTRARME