 22 Dec 2020
22 Dec 2020

 As micotoxinas (MX) são metabólitos secundários tóxicos produzidas por vários fungos filamentosos, principalmente:
As micotoxinas (MX) são metabólitos secundários tóxicos produzidas por vários fungos filamentosos, principalmente:
Aspergillus, Fusarium e Penicillium [1].
Ao consumir alimentos contaminados com micotoxinas, os animais sofrem uma série de efeitos tóxicos, tais como:

Dentre as principais estratégias para controle de micotoxinas, a mais utilizada é o emprego dos aditivos anti-micotoxinas no alimento nas fábricas de rações e nas granjas, para reduzir a concentração das micotoxinas.
Outras alternativas são a: inativação térmica, irradiação e diluição física [3].

Os aditivos anti-micotoxinas são, atualmente, a estratégia mais eficaz para diminuir a concentração de micotoxinas no animal. Existem dois grandes grupos de aditivos anti-micotoxinas: os sequestrantes e os inativadores enzimáticos.
Os sequestrantes evitam a absorção das micotoxinas através do trato gastrointestinal ligando-se a sua superfície.
Eles podem ser inorgânicos (Bentonitas, Aluminossilicatos, etc.) ou orgânicos (Parede de leveduras) [4,5].
Os inativadores enzimáticos possuem uma atividade biológica que permite alterar a estrutura química das MX e transformá-las em metabólitos com efeito tóxico menor ou nulo. Normalmente, eles podem ser uma bactéria, uma levedura ou só um extrato enzimático [6].
As MX classificam-se em polares e com menor polaridade, de acordo com sua estrutura química [7].
As micotoxinas polares, tais como a Aflatoxina B1 e a Fumonisina B1, são as mais polares das micotoxinas e são
![]()
adsorvidas mais facilmente do que as apolares.
Por sua vez, o peso molecular, a solubilidade, a capacidade de dissociação e as cargas iônicas, também desempenham umpapel essencial em sua capacidade de serem adsorvidas [8].

A Aflatoxina B1 tem uma maior taxa de adsorção do que Fumonisina B1; é por isso que Aflatoxina B1 é o
principal objetivo dos adsorventes [9].
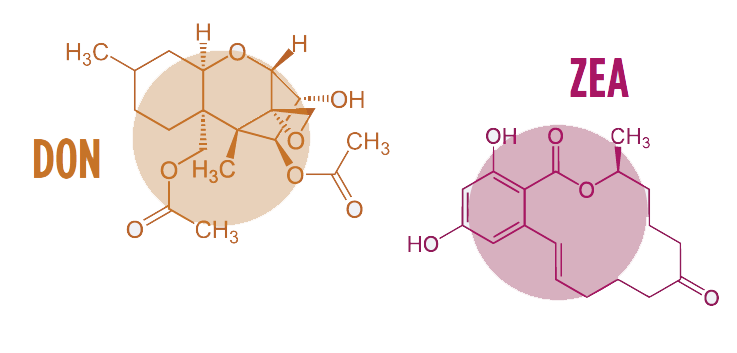
A maioria dos adsorventes têm demonstrado baixa e/ou nula capacidade para adsorver micotoxinas com menor polaridade, tais como o Desoxinivalenol (DON) e a Zearalenona (ZEA) [6].
![]() Por sua vez, os inativadores enzimáticos têm demonstrado ser a melhor opção para o controle dessas micotoxina
Por sua vez, os inativadores enzimáticos têm demonstrado ser a melhor opção para o controle dessas micotoxina
![]()
s [10, 11].
Até hoje, não existe um método analítico simples e prático que possa avaliar a capacidade de remoção das
micotoxinas in vivo, portanto os métodos de avaliação padrão são os ensaios in vitro.
![]() Apesar disso, é importante que as condições do ensaio in vitro sejam estritamente controladas para que possam ser bem semelhantes ao modelo in vivo, de maneira que os resultados possam ser replicados [12].
Apesar disso, é importante que as condições do ensaio in vitro sejam estritamente controladas para que possam ser bem semelhantes ao modelo in vivo, de maneira que os resultados possam ser replicados [12].

![]()
No presente ensaio, diagramou-se um modelo in vitro semelhante às condições do trato gastrointestinal dos suínos (Susscrofa), replicando os tempos de permanência do alimento em cada uma das estruturas anatômicas (estômago e intestino), os pHs de cada uma das estruturas, a temperatura, o tempo de permanência, a motilidade intestinal e a presença de enzimas digestivas próprias do animal. ![]()
Dessa maneira, foi possível criar um modelo que mimetiza, satisfatoriamente, in vitro às condições in vivo do animal.
![]()
As simulações in vitro foram realizadas imergindo o alimento contaminado com micotoxinas em suco gástrico artificial
(SGA) a um pH de 2,5 por 5 horas, ou em suco intestinal artificial (SAI) em pH de 6,5 por 2 horas, mimetizandoascondições do estômago e intestino, respectivamente.
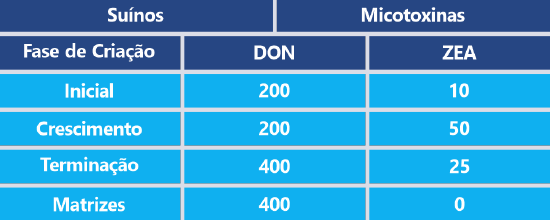
Os aditivos anti-micotoxinas avaliados, expostos na Tabela 1, foram selecionados de acordo com sua maior prevalência no mercado, sendo que as doses utilizadas nos testes foram sugeridas pelos fabricantes. O método utilizado para a avaliação foi o HPLC, por ser considerado o mais preciso para a avaliação das micotoxinas.

Tabela 1: Aditivos anti-micotoxinas e dose recomendada.
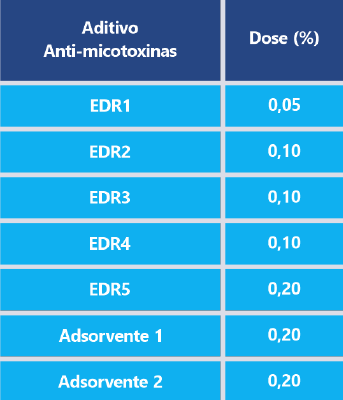
Fonte: Adaptado de Ko-Hua Tso et al., 2019. EDR: Reagentes de degradação enzimática.
A dose de desafio de DON utilizada no estudo foi de 1.000 ppb e a dose de desafio de ZEA foi de 500 ppb [13], de acordo com as diretivas da China Hygienic Standard for Feed (GB13078-2017) e os regulamentos da FDA.
Ambas as doses de micotoxinas utilizadas no ensaio ultrapassam os limites máximos toleráveis para a espécie (Tabela 2).

![]() Vale lembrar, que a prevalência média de DON conforme E-book de Micotoxinas Vetanco (2019) foi de 14% das amostras positivas para esta micotoxina, sendo a concentração média encontrada nas amostras de 500 ppb. Dados do LAMIC (2010-2020) referentes a aproximadamente 11.500 amostras trazem menores prevalências (5%) e concentrações (95 ppb) desta mesma micotoxina.
Vale lembrar, que a prevalência média de DON conforme E-book de Micotoxinas Vetanco (2019) foi de 14% das amostras positivas para esta micotoxina, sendo a concentração média encontrada nas amostras de 500 ppb. Dados do LAMIC (2010-2020) referentes a aproximadamente 11.500 amostras trazem menores prevalências (5%) e concentrações (95 ppb) desta mesma micotoxina.
Tabela 2: Recomendações do LAMIC de limites máximos toleráveis de micotoxinas (μg/kg) em alimentos para suinos.
Fonte: https://www.lamic.ufsm.br/site/legislacoes/ legislacao-brasil

No Gráfico 01 pode ser observada a capacidade de inativação ou adsorção de DON em função do tempo ao longo do modelo in vitro do trato gastrointestinal dos suínos.
Para as condições simuladas do intestino delgado (pH de 6,5) por 2h, os percentuais de remoção de DON no nível de 1.000 ppb foram 100%, 84%, 83%, 54% e 68% para os EDRs (1 a 5), respectivamente, e 15% e 19% para os adsorventes 1 e 2, respectivamente (Gráfico 1).
Gráfico 1: Percentual de remoção do desoxinivalenol (DON) 1.000 ppb com reagentes de degradação enzimática (linha sólida) e adsorventes (linha pontilhada) em simulações gastrointestinais de suínos.
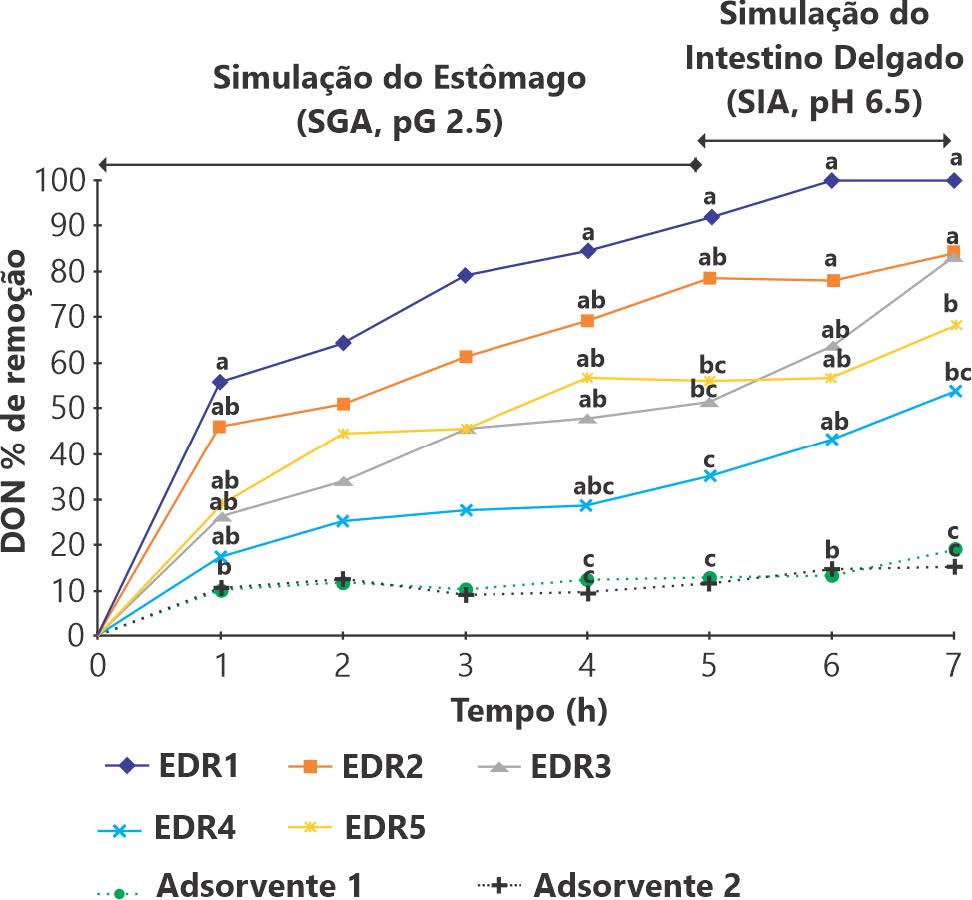
Fonte: Ko-Hua Tso et al., 2019.. : EDR1 a 0,05%; ■: EDR2 a 0,1%; ▲: 0,1% de EDR3; ×: EDR4 a 0,1%; □: 0,2% de EDR5; ●: 0,2% adsorvente 1; +: 0,2% e adsorvente2. a, b, c sem os mesmos sobrescritos diferem (p <0,05). SGA: Suco gástrico artificial; SIA: Suco intestinal artificial; DON: Desoxinivalenol; EDR: Reagentes de degradação enzimática.
Na simulação do intestino delgado (após 2h) a um pH de 6,5, todos os EDRs, apresentaram maior capacidade de remoção de DON do que os dois adsorventes (p <0,05), a capacidade de remoção de EDR1 foi maior que todos os outros EDRs (p <0,05). Não houve diferença estatística entre EDR2 e EDR3, ambos melhores que EDR4 e EDR5 (p <0,05). Também não foi encontrada diferença significativa no percentual de remoção entre dois adsorventes (Gráfico 1).
![]()
Vale lembrar, que a prevalência média de ZEA conforme E-book de Micotoxinas Vetanco (2019) foi de 4% das amostraspositivas para esta micotoxina, sendo a concentração média encontrada nas amostras de 72 ppb.
Dados do LAMIC (2010-2020) referentes a aproximadamente 17.000 amostras trazem maiores prevalências (75%) e concentrações menores (20 ppb) desta mesma micotoxina.
Após a avaliação das 5 primeiras horas em um pH de 2,5 (equivalente ao estômago dos suínos), os percentuais de remoção de ZEA no nível de 500 ppb foram de 100%, 89%, 50%, 30% e 57% para EDRs (1 a 5), e 0% e 30% para os Adsorventes 1 e 2, respectivamente (Gráfico 2). O percentual de remoção de ZEA do EDR1 foi melhor que EDR2 que, por sua vez, foi maior que todos os demais do EDRs e adsorventes (p <0,05).
Gráfico 2: Percentual de remoção da Zearalenona (ZEA) 500 ppb com reagentes de degradação enzimática (linha sólida) e adsorventes (linha pontilhada) em simulações gastrointestinais de suínos.
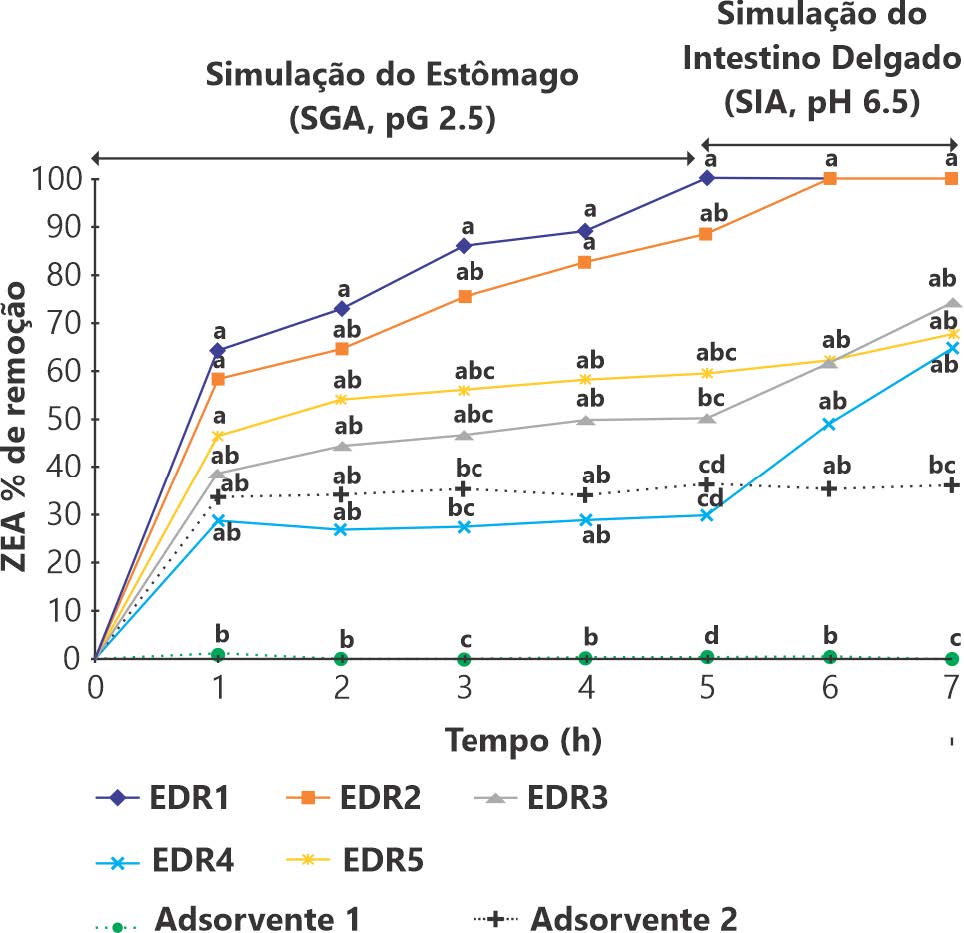
Fonte: Ko-Hua Tso et al., 2019.. : EDR1 a 0,05%; ■: EDR2 a 0,1%; ▲: 0,1% de EDR3; ×: EDR4 a 0,1%; □: 0,2% de EDR5; ●: 0,2% adsorvente 1; +: 0,2% e adsorvente2. a, b, c sem os mesmos sobrescritos diferem (p <0,05). SGA: Suco gástrico artificial; SIA: Suco intestinal artificial; DON: Desoxinivalenol; EDR: Reagentes de degradação enzimática.
Na simulação do intestino delgado (após 2h) a um pH de 6,5, os percentuais de remoção de ZEA a 500 ppb foram de 100%, 100%, 74%, 65%, e 68% para EDRs (1 a 5), respectivamente, e 0% e 36% para os adsorventes 1 e 2, respectivamente (Gráfico 2). Após 2h de simulação do intestino delgado, apenas o EDR1 e EDR2 apresentaram 100% de remoção de ZEA (p <0,05).
Foi possível observar como Detoxa Plus® e Detoxa Plus® New (produto em fase de desenvolvimento, não disponível para a venda) possuem uma capacidade de remoção significativamente superior aos outros inativadores enzimáticos e aos sequestrantes.
![]() Na diminuição do pH, devido a passagem da solução pelo estômago, ocorre um aumento ainda maior da capacidade de remoção do Detoxa Plus® e do Detoxa Plus® New, frente aos outros inativadores.
Na diminuição do pH, devido a passagem da solução pelo estômago, ocorre um aumento ainda maior da capacidade de remoção do Detoxa Plus® e do Detoxa Plus® New, frente aos outros inativadores.
Essa capacidade de eliminação das micotoxinas nos primeiros segmentos do trato gastrointestinal é específica do Detoxa Plus®, uma vez que, diferentemente dos demais produtos avaliados, as enzimas presentes neste produto possuem seu grau máximo de atividade enzimática em pH ácido, como pode ser observado no Gráfico 3.

Gráfico 3: Porcentagem de atividade enzimática em pH diferentes do Detoxa Plus®.
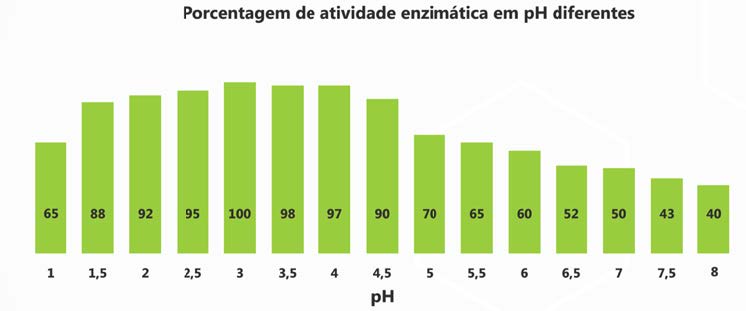
Quando da chegada da solução nos intestinos, provoca um aumento do pH (de 2,5 a 6,5). Desta forma, é perceptível que o processo de biotransformação do Detoxa Plus® se mantém, e nota-se aumento na capacidade dos demais inativadores.
Essa variação ocorre porque as enzimas dos outros produtos avaliados possuem seu grau máximo de atividade em um pH perto da neutralidade. Por sua vez, a atividade dos sequestrantes não varia, demonstrando que a capacidade de adsorção deles não foi influenciada pelo pH.

Durante a passagem total da solução pelo modelo animal (7,5 horas), foi possível obter uma capacidade de remoção TOTAL (100%) de DON com e Detoxa Plus® New e uma remoção de 84% com Detoxa Plus®, enquanto os outros inativadores enzimáticos tiveram uma ação de 83% (EDR3), 54% (EDR4) e 68% (EDR5).
Por sua vez, os adsorventes tiveram a capacidade de eliminação de DON de 15% para Adsorvente 1 e de 9% para Adsorvente 2.
Por último, na passagem total da solução pelo modelo animal (7,5 horas), foi possível obter uma capacidade de remoção TOTAL (100%) de ZEA com o Detoxa Plus® New e com o Detoxa Plus®, enquanto os outros inativadores enzimáticos tiveram uma ação de 74% (EDR3), 68% (EDR4) e 65% (EDR5).
Por sua vez, os adsorventes tiveram a capacidade de eliminação de ZEA de 0% para Adsorvente 1 e de 36% para Adsorvente 2.
![]()
A diferença de eliminação total de DON entre Detoxa Plus® e os demais produtos, ocorre devido a capacidade das enzimas do Detoxa Plus® agirem em um pH ácido, nos primeiros segmentos do trato gastrointestinal, o que permite ummaior tempo de ação total. Os outros produtos aumentam sua velocidade de ação na chegada ao intestino; porém, para esse momento, o alimento permanece pouco tempo no interior do intestino e ademais disso, uma vez nesta porção, já é iniciada a absorção das micotoxinas.
CONCLUSÃO
Os inativadores enzimáticos são uma opção viável para a eliminação das micotoxinas Desoxinivalenol e Zearalenona no modelo in vitro e, dentre eles, Detoxa Plus® e Detoxa Plus® New apresentaram maior capacidade de eliminação dentre os produtos testados, sendo que para a micotoxina Zearalenona, ambos tiveram 100% efetividade na remoção da mesma ao longo do trato gastrointestinal dos suínos.


1. Pierron, A.; Alassane-Kpembi, I.; Oswald, I.P. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health. Porc. Health Manag. 2016, 2, 21.
2. Wang, S.; Yang, J.; Zhang, B. et al. Deoxynivalenol impairs porcine intestinal host defense peptide expression in weaned piglets and IPEC-J2 Cells. Toxins 2018, 10, 541.
3. He, J.; Zhoua, T.; Christopher, Y.J. et al., Chemical and biological transformations for detoxification of trichothecene mycotoxins in human and animal food chains: A review. Trends Food Sci. Technol. 2010, 21, 67–76.
4. Nedeljkovic-Trailovic, J.; Trailovic, S.; Resanovic, R. et al., Comparative investigation of the eficacy of three diferent adsorbents against OTA-induced toxicity in broiler chickens. Toxins 2015, 7, 1174–1191.
5. Saminathan, M.; Selamat, J.; Abbasi Pirouz, A. et al., Effects of Nano-composite adsorbents on the growth performance, serum biochemistry, and organ weights of broilers fed with aflatoxin contaminated feed. Toxins 2018, 10, 345.
6. Kabak, B.; Dobson, A.D.; Var, I. Strategies to prevent mycotoxin contamination of food and animal feed: A review. Crit. Rev. Food Sci. Nutr. 2006, 46, 593–619.
7. Wang, G.; Lian, C.; Xi, Y. et al., Evaluation of nonionic surfactant modified montmorillonite as mycotoxins adsorbent for aflatoxin B1 and zearalenone. J. Colloid Interface Sci. 2018, 518, 48–56.
8. Huwig, A.; Freimund, S.; Kappeli, O. et al., Mycotoxin detoxication of animal feed by different adsorbents. Toxicol Lett. 2001, 122, 179–188.
9. Phillips, T.D.; Kubena, L.F.; Harvey, R.B. et al., Hydrated sodium calcium aluminosilicate: A high amity sorbent for aflatoxin. Poult. Sci. 1988, 67, 243–247.
10. Karlovsky, P.; Suman, M.; Berthiller, F. et al., Impact of food processing and detoxification treatments on mycotoxin contamination. Mycotoxin Res. 2016, 32, 179–205.
11. Tan, H.; Hu, Y.; He, J. et al., Zearalenone degradation by two Pseudomonas strains from soil. Mycotoxin Res. 2014, 30, 191–196.
12. Hahn, I.; Kunz-Vekiru, E.; Twaruzek, M. et al., Aerobic and anaerobic in vitro testing of feed additives claiming to detoxify deoxynivalenol and zearalenone. Food Addit. Contam. Part A 2015, 32, 922–933.
13. Park, D.L.; Troxell, T.C. US Perspective on mycotoxin regulatory issues. Adv. Exp. Med. Biol. 2002, 504, 277–285.
Assine agora a revista técnica de nutrição animal
AUTORES

Impactos dos microminerais essenciais na alimentação de aves e suínos
Simone Gisele de Oliveira
Modulação do metabolismo da vitamina D em leitões desmamados
Jérôme Lapointe
Alimentação de poedeiras de ciclo longo
Manuel Vázquez
Colostragem e seu impacto na produção de bovinos
Maria Luiza Fischer
Formulação de ração para monogástricos
Emanuel Isaque Cordeiro da Silva
A Indústria de Rendering: sustentabilidade e nutrição animal
Lucas Cypriano
Ação sinérgica de fitase e estimbiótico na qualidade óssea de frangos
Miliane Alves da Costa
E.C.O.Trace® Minerais organicamente ligados

Uso de pó secante à base de fitoativos para o bem-estar da leitegada
Gabriela Miotto Galli