Probióticos, Prebióticos e substâncias fitogênicas para otimizar a saúde intestinal de aves – Parte 1
A permeabilidade do trato intestinal controla a absorção de nutrientes e o transporte de substâncias extracelulares indesejadas, como bactérias e xenobióticos, além de substâncias não digeridas. Portanto, a saúde intestinal desempenha um papel essencial na patogênese de diversos distúrbios intestinais.
![]() A permeabilidade do intestino é controlada pela microbiota intestinal, secreções digestivas, barreiras físicas (mucina, revestimento de células epiteliais intestinais e junções estreitas) e produtos químicos como as citocinas.
A permeabilidade do intestino é controlada pela microbiota intestinal, secreções digestivas, barreiras físicas (mucina, revestimento de células epiteliais intestinais e junções estreitas) e produtos químicos como as citocinas.
ALTERAÇÃO NA MICROBIOTA INTESTINAL
Em condições normais, a relação simbiótica entre a microbiota intestinal e o hospedeiro determina de forma crucial a saúde intestinal. No entanto, uma alteração na microbiota intestinal pode levar a um desequilíbrio na relação hospedeiro-micróbio, o que é denominado “disbiose”.
![]() Vários fatores podem alterar a microbiota intestinal como: fatores antinutricionais em alimentos, metais pesados, substâncias tóxicas, toxinas bacterianas, herbicidas e antibióticos.
Vários fatores podem alterar a microbiota intestinal como: fatores antinutricionais em alimentos, metais pesados, substâncias tóxicas, toxinas bacterianas, herbicidas e antibióticos.
Esses impactos podem causar inflamação localizada, infecção extensa ou até envenenamento.
![]() Além disso, o epitélio intestinal forma conexões estreitas que atuam como uma barreira biológica que controla o trânsito paracelular de diferentes materiais através do epitélio intestinal, incluindo íons, solutos e água.
Além disso, o epitélio intestinal forma conexões estreitas que atuam como uma barreira biológica que controla o trânsito paracelular de diferentes materiais através do epitélio intestinal, incluindo íons, solutos e água.
Também funciona como uma barreira contra bactérias extracelulares, antígenos e xenobióticos.
BARREIRA INTESTINAL PREJUDICADA
[cadastrar] A função de barreira intestinal quando prejudicada, comumente conhecida como “intestino permeável”, é uma condição na qual o revestimento do intestino delgado é danificado, levando à infiltração de conteúdos luminais, como bactérias e seus componentes associados, incluindo toxinas, entre o epitélio células.
| Estas condições levam subsequentemente a danos celulares e/ou inflamação do intestino, que é caracterizada por níveis aumentados de endotoxinas derivadas de bactérias no sangue. |
![]()
| Este processo inflamatório consome quantidades significativas de nutrientes e subsequentemente tem efeitos negativos nas respostas metabólicas, particularmente nas respostas imunometabólicas e endócrinas. |
![]()
Como resultado, o desempenho dos animais é severamente reduzido.
Além disso, observações de campo na Europa mostraram que a indústria avícola enfrentou vários problemas após a proibição dos antibióticos promotores de crescimento (AGP), incluindo impactos negativos no desempenho, aspectos de bem-estar animal e problemas gerais de saúde.
 Em resposta à proibição dos AGP, várias alternativas aos antibióticos, tais como probióticos, prebióticos e substâncias fitogênicas têm sido desenvolvidas, testadas, avaliadas e utilizadas para a produção de frangos e perus com frequência crescente.
Em resposta à proibição dos AGP, várias alternativas aos antibióticos, tais como probióticos, prebióticos e substâncias fitogênicas têm sido desenvolvidas, testadas, avaliadas e utilizadas para a produção de frangos e perus com frequência crescente.
Nesta revisão discutimos o papel dessas alternativas na manutenção da função intestinal através da modulação da microbiota intestinal e os efeitos relacionados que beneficiam a saúde e a qualidade das aves.
MICROBIOTA INTESTINAL EM AVES
Os microrganismos que vivem no trato gastrointestinal (TGI) dos animais são um excelente exemplo de bactérias benéficas. Na verdade, o TGI abriga uma comunidade microbiana diversificada e abundante que fornece funções essenciais aos seus hospedeiros animais.
- Impacto no desenvolvimento e funcionamento
Embora o intestino esteja exposto a componentes da microflora desde o nascimento ou a eclosão, pouco se sabe sobre o seu impacto no desenvolvimento e função saudáveis.
 Os microrganismos são mais densamente povoados no TGI do que em qualquer outro órgão.
Os microrganismos são mais densamente povoados no TGI do que em qualquer outro órgão.
Os animais desenvolveram a capacidade de hospedar consórcios complexos e dinâmicos de microrganismos ao longo do seu ciclo de vida ao longo de milhões de anos de evolução.
 Como resultado, uma compreensão detalhada das contribuições destas comunidades microbianas para o desenvolvimento do hospedeiro e a fisiologia adulta é necessária para uma compreensão completa da biologia dos vertebrados.
Como resultado, uma compreensão detalhada das contribuições destas comunidades microbianas para o desenvolvimento do hospedeiro e a fisiologia adulta é necessária para uma compreensão completa da biologia dos vertebrados.
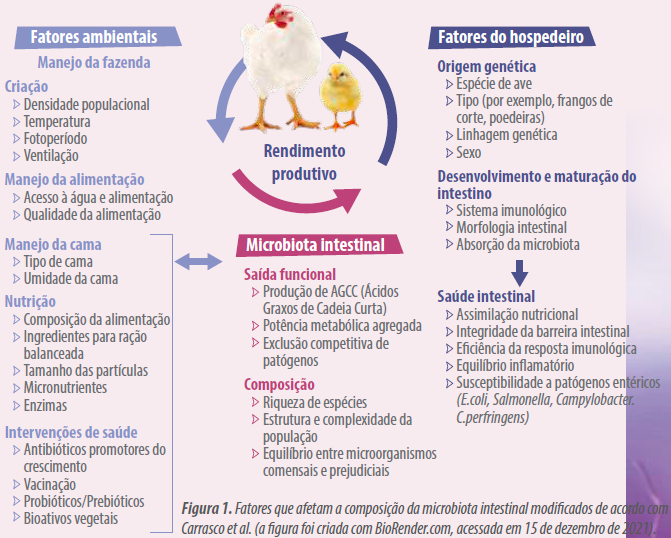
Espécies animais, raça, idade, nutrição, ambiente, criação, densidade populacional, stress e medicamentos podem ter impacto na delicada composição da microbiota intestinal. Os fatores que afetam a composição da microbiota intestinal são mostrados na Figura 1.
A maioria destas espécies de microflora intestinal não pode ser cultivada quando removida dos seus nichos, como é o caso na maioria dos ecossistemas complexos.
Probióticos, Prebióticos e Fitogênicos para saúde intestinal de aves – Parte 1
A colonização dos intestinos das aves já poderia começar durante a embriogênese e progredir para a formação de uma sociedade microbiana complexa e dinâmica.
![]() Com base em princípios estabelecidos durante a história animal, é provável que interações extensas e combinatórias microbianas-microbianas e microbianas-hospedeiro governem a montagem da microbiota.
Com base em princípios estabelecidos durante a história animal, é provável que interações extensas e combinatórias microbianas-microbianas e microbianas-hospedeiro governem a montagem da microbiota.
Ao comparar roedores livres de germes que foram criados sem exposição a microrganismos com aqueles que desenvolveram uma microbiota desde o nascimento, ou aqueles que foram colonizados com componentes da microbiota durante ou após o desenvolvimento pós-natal, uma variedade de funções do hospedeiro foram influenciadas pelas comunidades microbianas indígenas.
Probióticos, Prebióticos e Fitogênicos para saúde intestinal de aves – Parte 1
A microbiota, por exemplo:
• Dirige a formação de tecido linfóide associado ao intestino.
• Ajuda a educar o sistema imunológico.
• Afeta a integridade da barreira mucosa intestinal.
• Modula a proliferação e diferenciação de linhagens epiteliais.
• Regula a angiogênese.
• Modifica a atividade do sistema nervoso entérico.
• Desempenha um papel crítico na extração e processamento dos nutrientes consumidos.
Além disso, proteínas e produtos de degradação proteica, substâncias contendo enxofre e glicoproteínas endógenas ou estranhas podem ser metabolizadas pela microflora.
Algumas bactérias até se alimentam de produtos ou intermediários da fermentação bacteriana, incluindo H₂, lactato, succinato, formato e etanol, e os convertem em produtos finais que são novamente secretados no lúmen intestinal, como ácidos graxos de cadeia curta (SCFAs), processo que tem impacto direto na fisiologia intestinal.
 Mais de 90% de todas as espécies da microbiota intestinal em humanos e animais pertencem aos filos Bacteroidetes, Firmicutes e Actinobacteria, outros são Fusobacteria, Proteobacteria, Verrucomicrobia e Cyanobacteria.
Mais de 90% de todas as espécies da microbiota intestinal em humanos e animais pertencem aos filos Bacteroidetes, Firmicutes e Actinobacteria, outros são Fusobacteria, Proteobacteria, Verrucomicrobia e Cyanobacteria.
Nas galinhas, os filos Bacteroidetes e Firmicutes são os representantes mais predominantes no intestino. Em humanos e em vários animais, a relação entre Firmicutes e Bacteroidetes é um marcador associado à saúde/metabolismo.
• As espécies de Firmicutes decompõem polissacarídeos e produzem butirato.
• As espécies de Bacteroidetes degradam carboidratos complexos e sintetizam principalmente propionato.
Os mecanismos pelos quais as bactérias exercem efeitos no trato gastrointestinal são em grande parte desconhecidos, mas a manipulação destes gatilhos é considerada um meio promissor de alcançar saúde e desempenho ideais.
- Nutracêuticos
Supõe-se também que os princípios moleculares que ajudam a modificar e manter o funcionamento fisiológico normal da microbiota intestinal são derivados principalmente dos alimentos e seus suplementos, como os nutracêuticos.
Os nutracêuticos podem incluir:
• Nutrientes isolados (vitaminas, minerais, aminoácidos, ácidos graxos);
• Produtos fitoterápicos (polifenóis, ervas, especiarias);
• Suplementos dietéticos (probióticos, prebióticos, simbióticos, ácidos orgânicos, antioxidantes, enzimas); e
• Alimentos geneticamente modificados.
Esses nutracêuticos também auxiliam na prevenção de doenças infecciosas do hospedeiro.
Além disso, surgiram várias bactérias multirresistentes, tornando esta crise global. Serão necessários nutracêuticos para reduzir o uso de antibióticos.
- Bactéria ácido láticas
As bactérias ácido láticas têm sido usadas como suplementos dietéticos desde os tempos pré-cristãos, quando os humanos comiam leite fermentado.
 Este tema foi analisado cientificamente no século passado, quando Eli Metchnikoff (1845–1916), trabalhando no Instituto Pasteur de Paris, descobriram uma ligação entre a longevidade humana e a importância de manter uma mistura saudável de microrganismos benéficos e patogênicos no intestino.
Este tema foi analisado cientificamente no século passado, quando Eli Metchnikoff (1845–1916), trabalhando no Instituto Pasteur de Paris, descobriram uma ligação entre a longevidade humana e a importância de manter uma mistura saudável de microrganismos benéficos e patogênicos no intestino.
 Metchnikoff e os seus colaboradores identificaram o ‘bacilo búlgaro’, muito provavelmente Lactobacillus bulgaricus, a partir do leite estragado, que foi utilizado em ensaios subsequentes.
Metchnikoff e os seus colaboradores identificaram o ‘bacilo búlgaro’, muito provavelmente Lactobacillus bulgaricus, a partir do leite estragado, que foi utilizado em ensaios subsequentes.
| Hoje, esse microrganismo é conhecido como Lactobacillus delbrueckii subespécie bulgaricus, que é uma das bactérias usadas para fermentar o leite e fazer iogurte. Após a morte de Metchnikoff em 1916, o foco do trabalho nesta área mudou para os Estados Unidos. |
![]()
| No final da década de 1940, descobriu-se que os antibióticos adicionados à ração dos animais de fazenda ajudavam no seu crescimento. A necessidade de compreender os mecanismos por trás deste impacto motivou novas pesquisas sobre a composição da microflora intestinal e como ela pode afetar a saúde do animal hospedeiro. |
Os avanços na bacteriologia e a maior disponibilidade de animais livres de germes ajudaram a avaliar o impacto dos ocupantes intestinais recentemente identificados no hospedeiro.
Com base nestes estudos, ficou claro que o Lactobacillus acidophilus não era o único Lactobacillus no intestino, e uma variedade de outras espécies foram examinadas e eventualmente incluídas em formulações probióticas.
Os principais representantes da microbiota intestinal das aves estão resumidos na Figura 2. Compreender como o intestino amadurece e se desenvolve nas galinhas e como os suplementos alimentares beneficiam o desempenho intestinal aumentará a eficiência alimentar, o crescimento e a saúde geral.
Figura 2. Microbiota em galinhas, resumida de Shang et al.
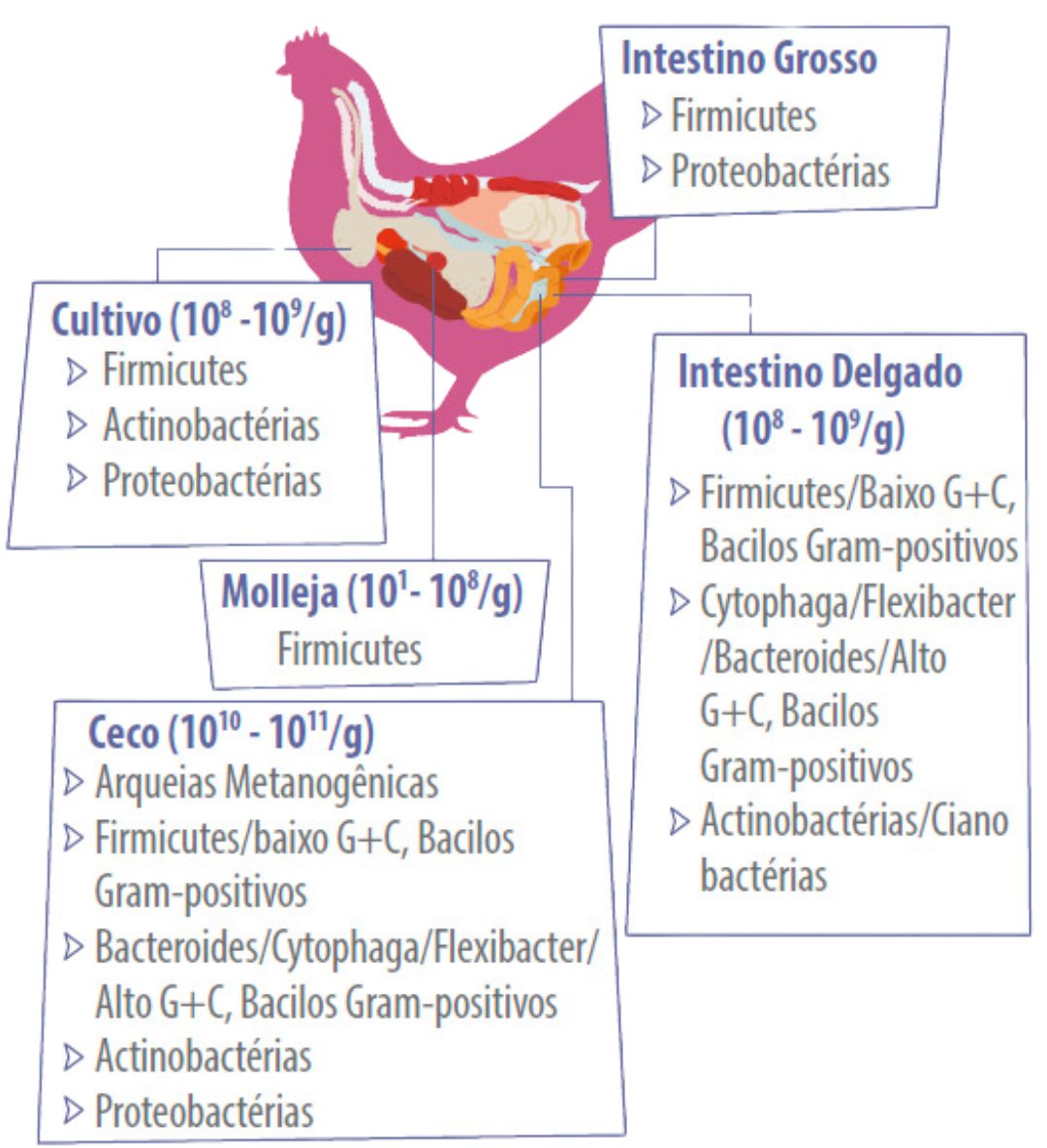
(A figura foi criada com BioRender.com, acessada em 15 de dezembro de 2021)
BARREIRA INTESTINAL E JUNÇÕES ESTREITAS
Os enterócitos são a base da monocamada da mucosa intestinal que protege o hospedeiro do ambiente externo. A Figura 3 mostra um diagrama da barreira epitelial intestinal e algumas interações com a microbiota intestinal.
• Os enterócitos são conectados pelas chamadas junções estreitas (TJs), que constituem um cinturão contínuo de contatos íntimos formados durante o processo de montagem de transmembranas integrais (ocludina, claudinas, moléculas de adesão juncional (JAM) e tricelulina) e membranas periféricas. (zonula occludens). -1 (ZO-1), ZO-2 e ZO-3).
• As proteínas TJ estão localizadas entre os enterócitos adjacentes, selando o espaço paracelular e regulando a permeabilidade da barreira intestinal.
Portanto, essas proteínas impedem o trânsito de microrganismos, toxinas e outros antígenos da luz intestinal para a circulação sistêmica.
A formação e função das junções estreitas são controladas pelas vias de transdução de sinal intracelulares:
• Proteína Quinase C (PKC), A (PKA) e Sinalização G (PKG),
• Fosfatase-Rho, cadeia leve da miosina (MLC) quinase (MLCK), sinalização MAPK e
• Fosfatidilinositol 3 quinase (PI3K/Akt).
Enquanto isso, a interrupção das junções estreitas por fatores bacterianos pode ocorrer nas seguintes etapas:
• O lipopolissacarídeo bacteriano (LPS) ativa as células epitelial intestinal e macrófagos;
• Essas células secretam citocinas pró-inflamatórias, como IL-1ß; e
• A IL-1β ativa ainda mais essas células e desencadeia a sinalização intracelular, como a p38 MAP quinase, que subsequentemente ativa a MLCK. F
Em última análise, estes processos levam ao aumento da permeabilidade intestinal. Portanto, a síndrome do intestino permeável se desenvolve como resposta a patógenos, privação alimentar e estresse.
![]()
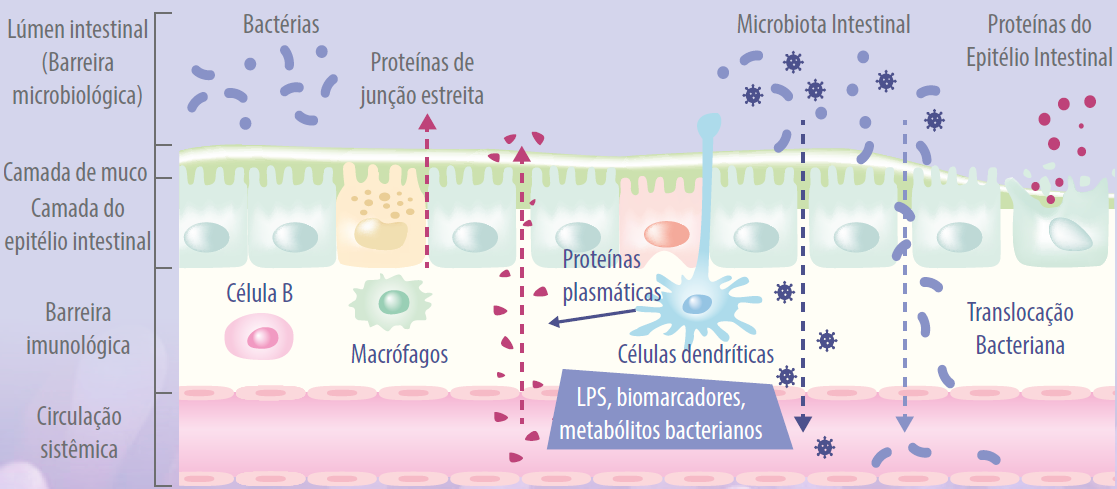
Figura 3. Barreira epitelial intestinal e interação da microbiota intestinal.
BIOMARCADORES RELACIONADOS À SAÚDE INTESTINAL DOS ANIMAIS
As interações entre a função da barreira epitelial, a inflamação intestinal e o ambiente microbiano influenciam a saúde intestinal de aves. Portanto, a descoberta de biomarcadores confiáveis e generalizados para medir a inflamação intestinal e a função de barreira é uma área importante de pesquisa em andamento. Um resumo de alguns dos biomarcadores conhecidos relacionados à saúde intestinal é apresentado na Tabela 1.
![]() Para estudar a saúde intestinal, também é importante desenvolver modelos intestinais inflamatórios com diferentes condições de desafio (fatores antinutricionais, patógenos, toxinas e gatilhos ambientais).
Para estudar a saúde intestinal, também é importante desenvolver modelos intestinais inflamatórios com diferentes condições de desafio (fatores antinutricionais, patógenos, toxinas e gatilhos ambientais).
A inflamação também pode estar associada ao estresse oxidativo e a alterações na expressão de genes relacionados ao estresse oxidativo, indicando que o estresse oxidativo pode desempenhar um papel crítico na função fisiológica intestinal.
Uma técnica quantitativa utilizada para avaliar a integridade das proteínas de junção estreita em monocamadas de células epiteliais é a medição da resistência elétrica transepitelial (TEER). A respiração mitocondrial é necessária para manter o TEER, implicando que a oxidação desempenha um papel fundamental na a estabilidade de junções apertadas em células Caco-2.
Segundo Janssen-Duijghuijsen et al., a redução da produção de adenosina trifosfato mitocondrial (ATP) resultou em uma diminuição da permeabilidade intestinal e aumento na expressão dos genes ocludina e claudina-1, mas diminuição na expressão dos genes claudina-2 e claudina-7.
![]() Consequentemente, foi estabelecida uma conexão direta entre a função mitocondrial, o estado energético celular e a integridade intestinal.
Consequentemente, foi estabelecida uma conexão direta entre a função mitocondrial, o estado energético celular e a integridade intestinal.
- Biomarcador de função intestinal
O estresse oxidativo é frequentemente quantificado pelo exame de metabólitos formados durante ou após um processo oxidativo.
• Uma enzima antioxidante que desintoxica subprodutos metabólicos prejudiciais e normalmente é medida como um biomarcador é a superóxido dismutase (SOD).
• Outros biomarcadores que poderiam ser usados para medir a atividade antioxidante incluem substâncias reativas ao ácido tiobarbitúrico (TBARS), que são metabólitos formados durante a peroxidação; capacidade antioxidante total; e o ensaio de Griess, que utiliza a decomposição de nitritos e nitratos para determinar a concentração de óxido nítrico dentro da célula.
Tabela 1. Biomarcadores potenciais para avaliar a saúde intestinal de aves.
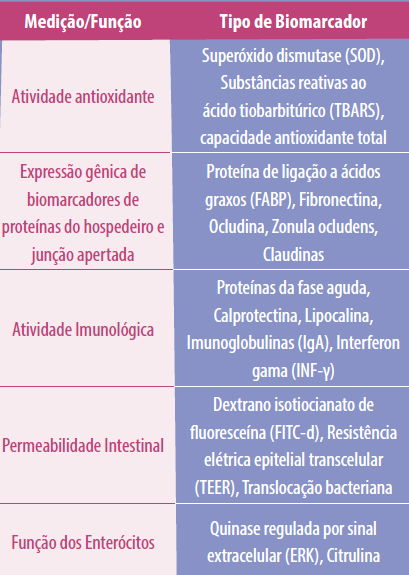
Adaptado de Chen et al. e Baxter et al.
- Biomarcadores de saúde intestinal
Os biomarcadores para avaliação da saúde intestinal de aves também podem estar relacionados ao monitoramento da função intestinal.
 A citrulina é um subproduto nitrogenado do metabolismo da glutamina que pode ser convertido em arginina e é produzido principalmente nos enterócitos do intestino delgado.
A citrulina é um subproduto nitrogenado do metabolismo da glutamina que pode ser convertido em arginina e é produzido principalmente nos enterócitos do intestino delgado.
• Os níveis plasmáticos de citrulina têm sido associados à absorção intestinal de marcadores como o manitol em leitões antes do desmame, indicando que a citrulina pode ser usada para controlar a função intestinal.
 A quinase regulada por sinal extracelular (ERK) é outro biomarcador que pode ser considerado uma opção porque serve como uma via de sinalização crítica para a proliferação epitelial intestinal e cicatrização tecidual.
A quinase regulada por sinal extracelular (ERK) é outro biomarcador que pode ser considerado uma opção porque serve como uma via de sinalização crítica para a proliferação epitelial intestinal e cicatrização tecidual.
• Portanto, a atividade sérica de ERK pode refletir perturbação intestinal causada por um estressor.
- Biomarcadores relacionados à atividade imunológica
No caso de biomarcadores relacionados à atividade imunológica que podem influenciar a saúde intestinal.
![]() A IgA secretora (SIgA) é um componente crítico do sistema imunológico humoral e a imunoglobulina primária que interage com patógenos na superfície da mucosa. Consequentemente, tem estreita relação com a homeostase do meio intestinal.
A IgA secretora (SIgA) é um componente crítico do sistema imunológico humoral e a imunoglobulina primária que interage com patógenos na superfície da mucosa. Consequentemente, tem estreita relação com a homeostase do meio intestinal.
Uma citocina pró-inflamatória com propriedades imunoestimulantes e imunomodulador é o interferon-gama (INF-γ).
• Esta citocina tem sido associada à endocitose de proteínas de junção estreita. Portanto, tem um impacto viável na permeabilidade intestinal.
Em última análise, é provável que tanto as respostas imunitárias inatas como as adaptativas forneçam biomarcadores viáveis para avaliar a saúde intestinal.
- Análise histomorfológica
A análise histomorfológica é outro tipo de avaliação altamente influenciada por um equilíbrio adequado do ambiente intestinal.
 A altura das vilosidades, a profundidade das criptas e a relação entre a altura das vilosidades e a profundidade das criptas são parâmetros que podem ser usados para calcular a área de absorção em diferentes seções do intestino e, ao mesmo tempo, ser indicativos da renovação das células epiteliais na barreira intestinal.
A altura das vilosidades, a profundidade das criptas e a relação entre a altura das vilosidades e a profundidade das criptas são parâmetros que podem ser usados para calcular a área de absorção em diferentes seções do intestino e, ao mesmo tempo, ser indicativos da renovação das células epiteliais na barreira intestinal.
- Biomarcadores de permeabilidade intestinal
A translocação bacteriana e a expressão gênica de TJs, como claudinas, ocludinas e zônula ocludens (ZO-1), são biomarcadores de permeabilidade intestinal usados para avaliar a saúde intestinal.
A translocação bacteriana tem sido associada a doenças como condronecrose com osteomielite em frangos de corte e matrizes. Sugerindo a migração de patógenos entéricos para as vértebras torácicas.
 Foi demonstrado que TJs como a ocludina são regulados negativamente em pacientes humanos com doenças inflamatórias intestinais (doença de Crohn) e em galinhas sob condições de desafio nutricional à saúde intestinal, revelando o papel crítico de TJs como a ocludina.
Foi demonstrado que TJs como a ocludina são regulados negativamente em pacientes humanos com doenças inflamatórias intestinais (doença de Crohn) e em galinhas sob condições de desafio nutricional à saúde intestinal, revelando o papel crítico de TJs como a ocludina.
Um conjunto diferente de biomarcadores candidatos inclui proteínas de ligação a ácidos graxos (FABPs), que são acompanhantes lipídicos intracelulares responsáveis por orquestrar o metabolismo lipídico e vias críticas sensíveis aos lipídios em macrófagos e adipócitos.
 A FABP2 foi estudada em humanos e galinhas, mostrando uma resposta de regulação negativa quando há lesão na barreira intestinal.
A FABP2 foi estudada em humanos e galinhas, mostrando uma resposta de regulação negativa quando há lesão na barreira intestinal.
Outro biomarcador bem conhecido que tem sido utilizado em aves para avaliar a permeabilidade intestinal é a medição do isotiocianato dextrano de fluoresceína (FITC-d) no soro.
Durante a inflamação intestinal, a ruptura das proteínas TJ permite que a molécula FITC-d se difunda na circulação sistêmica, permitindo a medição deste biomarcador sob diferentes condições desafiadoras, incluindo 24 horas de jejum em frangos de corte.
 Alguns biomarcadores não invasivos que estão sendo estudados atualmente em amostras fecais por diferentes grupos de pesquisa são a fibronectina, a calprotectina e a lipocalina. Esses candidatos a biomarcadores mostraram resultados promissores em galinhas; No entanto, também houve inconsistências entre os estudos.
Alguns biomarcadores não invasivos que estão sendo estudados atualmente em amostras fecais por diferentes grupos de pesquisa são a fibronectina, a calprotectina e a lipocalina. Esses candidatos a biomarcadores mostraram resultados promissores em galinhas; No entanto, também houve inconsistências entre os estudos.
Em última análise, o objetivo é continuar a busca por biomarcadores da saúde intestinal de aves que pode ser facilmente medida a partir de amostras que não requerem alto tempo de preparação ou custo.
Referências bibliográficas sob consulta junto ao autor. [/cadastrar]
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar esta publicação e muito mais conteúdo especializado. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em nutriNews
REGISTRE-SE