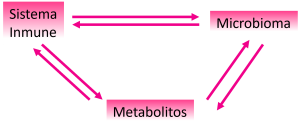
La microbiota influye en el desarrollo del sistema inmunitario; y el sistema inmunitario, a su vez, da forma a la composición de la microbiota intestinal (Nicholson y Wilson, 2003).
 14 Mar 2022
14 Mar 2022
Triptófano: impacto sobre la microbiota intestinal de los animales
La microbiota intestinal y los metabolitos microbianos son importantes para mantener intestinos sanos. Ésta puede influir en el alcance y la calidad de la respuesta del sistema inmunitario; a su vez, el sistema inmunitario participa en la regulación de la localización y composición de la microbiota intestinal.
 Estudios recientes han enfatizado los profundos efectos de la dieta y los nutrientes en la localización y composición de la microbiota intestinal, así como en la conexión entre ésta y las vías inmunológicas (Thorburn et al., 2014).
Estudios recientes han enfatizado los profundos efectos de la dieta y los nutrientes en la localización y composición de la microbiota intestinal, así como en la conexión entre ésta y las vías inmunológicas (Thorburn et al., 2014).
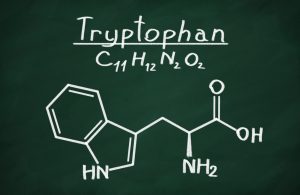
Como nutriente esencial en los mamíferos, el L-triptófano (Trp) y sus metabolitos endógenos están implicados en la homeostasis inmunitaria intestinal. La manipulación de la composición microbiana intestinal puede modular las concentraciones plasmáticas de Trp y sus metabolitos (Clarke et al., 2014).
El microbioma, que consta de microorganismos y sus genomas colectivos, modula el fenotipo metabólico del huésped e influye en su sistema inmunitario (Gordon, 2012). Las interacciones entre la microbiota intestinal y el sistema inmunitario del huésped comienzan en el nacimiento:
La microbiota influye en el desarrollo del sistema inmunitario; y el sistema inmunitario, a su vez, da forma a la composición de la microbiota intestinal (Nicholson y Wilson, 2003).
![]()
[registrados] Más adelante en la vida, la microbiota intestinal también influye en el reclutamiento de células inmunitarias e inicia la inflamación. La diafonía entre la microbiota intestinal y los enterocitos da forma al entorno intestinal e influye profundamente en la homeostasis inmune intestinal (Hold, 2016), que dura toda la vida.
Las alteraciones en la microbiota intestinal, junto con el aumento de la permeabilidad intestinal (intestino permeable), son ampliamente reconocidas como relevantes para la patogénesis de varias enfermedades (Anderson et al., 2016).
La conexión entre los microorganismos y el sistema inmunológico del huésped está mediada por una serie de moléculas (Anders et al., 2013) y procesos de señalización, que pueden afectar el intestino, el hígado, el cerebro y otros órganos.
Por otro lado, el sistema inmunitario intestinal juega un papel crucial en la exposición de las bacterias a los tejidos del huésped, aliviando el potencial de resultados patológicos y determinando la estratificación de las bacterias intestinales en el lado luminal de la barrera epitelial (Blumberg y Powrie, 2012).
Impacto sobre la salud intestinal del Triptófano
Además de servir como sustrato para la síntesis de proteínas, el Triptófano se metaboliza principalmente a través de dos vías metabólicas:
Aproximadamente el 95% del Trp ingerido se degrada a quinurenina, ácido quinurénico (KA), ácido quinolínico, ácido picolínico y nicotinamida adenina dinucleótido (NAD), mientras que el 1-2% del Trp ingerido se convierte en serotonina (5-HT) y melatonina.
La microbiota intestinal puede utilizar directamente Trp, lo que limita parcialmente la disponibilidad de este aminoácido para el huésped.
Los informes han demostrado que la comunidad bacteriana puede influir en el metabolismo del Triptofano y el sistema serotoninérgico.
 Los niveles circulantes de Trp totales aumentan en ratones libres de gérmenes (LG) que carecen de microbiota intestinal (El Aidy et al., 2012; Mardinoglu et al., 2015); las concentraciones circulantes de serotonina también disminuyen (Clarke et al., 2013). A su vez, el agotamiento de Trp del huésped puede reducir la proliferación microbiana y afecta la inmunidad intestinal (Hashimoto et al., 2012).
Los niveles circulantes de Trp totales aumentan en ratones libres de gérmenes (LG) que carecen de microbiota intestinal (El Aidy et al., 2012; Mardinoglu et al., 2015); las concentraciones circulantes de serotonina también disminuyen (Clarke et al., 2013). A su vez, el agotamiento de Trp del huésped puede reducir la proliferación microbiana y afecta la inmunidad intestinal (Hashimoto et al., 2012).
Quinureninas
Las quinureninas poseen actividades antimicrobianas, que pueden impactar directamente en la proliferación de la microbiota intestinal (Niño-Castro et al., 2014).
Indol
Especies bacterianas como E. coli, Proteus vulgaris, Paracolobactrum coliforme, Achromobacter liquefaciens y Bacteroides spp son capaces de producir indol (Keszthelyi et al., 2009).
![]() Recientemente, el indol ha sido reconocido como una molécula de señalización que puede regular la motilidad bacteriana, la formación de biopelículas, la resistencia a los antibióticos, la formación de células persistentes y la virulencia (Li y Young, 2013).
Recientemente, el indol ha sido reconocido como una molécula de señalización que puede regular la motilidad bacteriana, la formación de biopelículas, la resistencia a los antibióticos, la formación de células persistentes y la virulencia (Li y Young, 2013).
![]() En el intestino porcino con una dieta baja en polisacáridos sin almidón, la concentración máxima de indol (~0,12 mM) se encontró en la parte distal del ciego, donde se habían asentado la mayoría de las bacterias intestinales, mientras que la cantidad de indol en el intestino posterior fue menor en animales alimentados con una dieta alta en polisacáridos sin almidón (Knarreborg et al., 2002).
En el intestino porcino con una dieta baja en polisacáridos sin almidón, la concentración máxima de indol (~0,12 mM) se encontró en la parte distal del ciego, donde se habían asentado la mayoría de las bacterias intestinales, mientras que la cantidad de indol en el intestino posterior fue menor en animales alimentados con una dieta alta en polisacáridos sin almidón (Knarreborg et al., 2002).
La exposición al indol puede fortalecer la barrera mucosa y la producción de mucina al inducir la expresión de genes asociados, lo que aumenta la resistencia a la invasión de patógenos.
Para las células inflamatorias, la exposición al indol puede suprimir la activación de NF-κB y la producción de quimiocinas proinflamatorias y, al mismo tiempo, aumentar la producción de citocinas antiinflamatorias, mejorando así la inflamación y el daño.
Escatol
El escatol es otro metabolito derivado de la microbiota intestinal del Triptofano (Jensen et al., 1995). Puede influir en el crecimiento y la reproducción de ciertas bacterias intestinales y tiene efectos bacteriostáticos sobre las enterobacterias Gram negativas.
La producción de escatol se asocia tanto con estados de salud como de enfermedad:
![]() En el ganado bovino, la administración intrarruminal e intravenosa de escatol induce características clínicas y lesiones pulmonares similares a la enfermedad inducida por Triptofano.
En el ganado bovino, la administración intrarruminal e intravenosa de escatol induce características clínicas y lesiones pulmonares similares a la enfermedad inducida por Triptofano.
Triptamina
La triptamina es un neurotransmisor que actúa sobre el sistema nervioso entérico para modular la homeostasis intestinal (Wlodarska et al., 2015) y puede inducir la secreción de iones por parte de las células epiteliales intestinales.
Conclusiones
Nuestro conocimiento sobre las interacciones entre el metabolismo del Trp, la microbiota intestinal y la inmunidad del huésped se ha ampliado considerablemente en los últimos años. La creciente evidencia muestra que:
tienen efectos profundos en la composición microbiana intestinal, las funciones microbianas y las interacciones entre el sistema inmunológico del huésped y la microbiota intestinal.
En consecuencia, la microbiota intestinal afecta la absorción y el metabolismo del Triptófano del huésped y, directa o indirectamente, regula las respuestas fisiológicas e inmunitarias posteriores del huésped♦
[/registrados]
Suscríbete ahora a la revista técnica de nutrición animal
AUTORES

Achaparramiento del maíz: sus efectos sobre la calidad nutricional
Virginia Fain Binda
Harina zootécnica: Ficha de materia prima
Alba Cerisuelo
Efecto de Detoxa® Plus sobre los parámetros productivos en gallinas de postura
Cecilia Rodriguez
Optimizando el desempeño en situaciones de estrés
Horta Felipe
TechnoSpore: La cepa probiótica de Biochem que une lo mejor de dos mundos

El impacto de la suplementación de fibra dietética en lechones
Gustavo Cordero
Grasas oxidadas en porcinos: riesgos y consideraciones. Parte III
María Alejandra Pérez Alvarado
Proteína unicelular: alternativa sostenible a la proteína convencional
Meryem El Kissi
Nutrición de las terneras: Claves para asegurar el éxito. Parte II
José Luis Repetto
Carbohidratos para gatos ¿alternativa energética o enemigo silencioso? Parte II
Ada E. Lugo