Neste segundo artigo vamos entender sobre os processos empregados para separação, concentração e os benefícios do uso aplicado dos constituintes das leveduras como ingrediente funcional na alimentação animal.
![]() A levedura apresenta uma composição extremamente rica e por meio do processamento da sua biomassa é possível aumentar a funcionalidade de determinados constituintes e, assim, realizar aplicações mais direcionadas como soluções na nutrição animal.
A levedura apresenta uma composição extremamente rica e por meio do processamento da sua biomassa é possível aumentar a funcionalidade de determinados constituintes e, assim, realizar aplicações mais direcionadas como soluções na nutrição animal.
O seu fracionamento produz derivados que podem ser adicionados em dietas como a levedura autolisada, que abordamos no primeiro artigo (clique aqui se quiser ler o artigo na íntegra), além do extrato de levedura (citoplasma) e a parede celular (PC) que são obtidos pelo desmembramento da fração solúvel (extrato) e insolúvel (parede celular) das células autolisadas e que explicaremos com mais detalhes.


Após o processo de autólise, a biomassa é submetida a um fracionamento por centrifugação para obtenção da parede celular (Figura 1) e, em seguida, seca em spray dryer. Para garantir que o produto seja constituído apenas por parede celular, é necessário um controle continuado do processo para completa extração da parte solúvel.
Para isto, são realizadas quantas centrifugações forem necessárias, além da adição de ingredientes como cloreto de sódio que auxiliam na remoção e purificação da parede. Desta forma, as análises de proteína bruta (abaixo de 35%) durante o processo são procedimentos coadjuvantes para determinação e garantia de um produto constituído por 100% de parede celular, como é o caso do MAXIMOS.
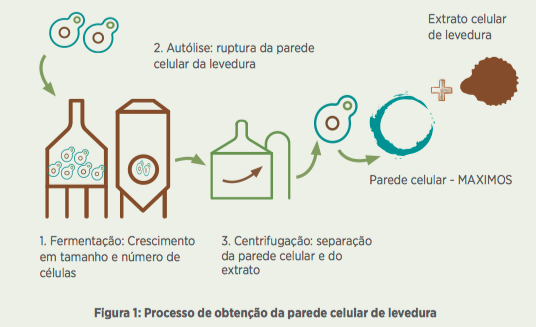

O papel principal da parede celular na levedura está relacionado à proteção física, ao controle osmótico e às propriedades de permeabilidade da célula (SMITH et al., 2000; KLIS et al., 2002).
![]() Assim, a parede celular não é uma estrutura estática, pois em reposta às condições do meio, a levedura é capaz de se adaptar, o que pode alterar o espessamento de sua parede celular como um mecanismo de auto proteção. A concentração dos polissacarídeos nas células de leveduras viáveis poderia, portanto, ser uma consequência da remodelação desta parede.
Assim, a parede celular não é uma estrutura estática, pois em reposta às condições do meio, a levedura é capaz de se adaptar, o que pode alterar o espessamento de sua parede celular como um mecanismo de auto proteção. A concentração dos polissacarídeos nas células de leveduras viáveis poderia, portanto, ser uma consequência da remodelação desta parede.
![]() Deste modo, condições de fermentação, como aquelas aplicadas na produção de panificação, cerveja e etanol, influenciam na composição da parede celular e, consequentemente, na quantidade de cada constituinte presente.
Deste modo, condições de fermentação, como aquelas aplicadas na produção de panificação, cerveja e etanol, influenciam na composição da parede celular e, consequentemente, na quantidade de cada constituinte presente.

De forma geral, a parede celular da levedura é composta por 85% de polissacarídeos e 15% de proteínas (BLASCOL et al, 2011).
A distribuição destes constituintes se organiza em duas camadas principais que são compostas basicamente por três macromoléculas: mananoproteína (20-23%), um complexo no qual o polissacarídeo manano está covalentemente ligado à proteína; glucana (48-60%), um polissacarídeo com ligações do tipo β-1,3 e β-1,6 de glicoses e quitina (0,6 – 2,7%), um polímero de ligações β-1,4 N-acetilglicosamina. (FLEET, 1985; HARTLAND et al., 1994; KLIS, 1994).

A camada externa, composta de mananoproteínas (MAP), representa de 20 a 23% do peso seco da parede celular. As cadeias de carboidratos, os mananoligossacarídeos, das MAP, são responsáveis pelo reconhecimento e interações célula-célula e com meio externo, além de serem capazes de determinar a especificidade imunológica de leveduras (COSTA et al., 2012).
As MAP são capazes de limitar a ação de enzimas exógenas como um mecanismo de defesa, conferindo resistência e proteção às células vivas de leveduras e limitando o acesso a todo seu conteúdo citoplasmático (COSTA et al., 2012), sendo estes um dos motivos pelos quais o processo de autólise (lise da parede celular) é tão importante para a obtenção de um produto com maior funcionalidade no animal.
A camada interna da parede celular possui uma rede tridimensional formada de cadeias β-(1,3)-glucana interligada a β-1,6-glucana e quitina, e confere a elasticidade e estrutura de parede celular de leveduras (KLIS et al., 2006).

Por sua vez, a β-(1,6)-glucana, corresponde à cerca de 5% do peso seco da parede celular e são moléculas relativamente pequenas, com cerca de 140 resíduos de glicose, atuando como apoio para a organização e integridade da camada de mananoproteínas (ROEMER et al., 1994).


As β-glucanas pertencem a uma classe conhecida como MRB (modificadores da resposta biológica), pois são capazes de alterar no animal a resposta biológica pela ação no sistema imune, auxiliando as células normais a produzir mensageiros químicos (mediadores) que melhoram a capacidade do sistema imunológico de identificar e produzir substâncias de defesa.
Esta atividade está relacionada ao tipo de ligações glicosídicas, peso molecular, conformação espacial, grau de polimerização e de ramificação (DIETRICHMUSZALSKA et al., 2011). Por exemplo, dentre as diferentes conformações, a tripla hélice é a que apresenta a maior atividade biológica (HA et al., 2002).
Assim, algumas moléculas de β-glucana podem ser capazes de modular a resposta imune desencadeando uma série de eventos como a produção de fatores quimiotáticos que induzem à migração de leucócitos para o sítio da infecção (LIU et al., 2008).
Também, o reconhecimento da β-glucana pelo sistema imune dos animais pode ocorrer por meio de receptores de superfície celular como dectin-I, já identificados em células imunes como macrófagos, monócitos e neutrófilos (BROWN e GORDON, 2005), além de estarem envolvidos na resposta imune específica pela expressão de diversas citocinas (LEE et al., 2001).

Além de serem classificadas como MRB, muitos trabalhos têm relacionado as β-glucanas à capacidade de se ligarem seletivamente às micotoxinas polares e apolares como zearalenona e aflatoxinas, através das ligações entre as pontes de hidrogênio e forças de Van der Waals.

Por meio de ensaios in vitro, Yiannikouris et al. (2003) relataram que este mecanismo ocorre devido à estrutura tridimensional da parede celular da levedura, que aumenta a superfície de contato das β-glucanas, de forma a expor um maior número de polos de ligação, aumentando a disponibilidade destes e, consequentemente, a eficiência em adsorver as micotoxinas.
Por consequência, a parede celular como o MAXIMOS apresenta uma função auxiliar de adsorção, sendo mais um mecanismo de apoio para a saúde animal.

O mananoligossacarídeo (MOS) presente na parede celular atua por meio de mecanismos de afinidade, sendo capaz de aderir-se às bactérias patogênicas no intestino do animal, impedindo que estas iniciem um processo de colonização, ou ainda modulando e preparando o sistema imunológico para proteção contra um processo infeccioso (SHANE, 2001).
Em relação ao primeiro mecanismo, sabe-se que para uma bactéria iniciar o processo infeccioso é necessário aderir-se aos receptores da superfície epitelial. As fímbrias manose-sensíveis (tipo 1) têm grande incidência entre as enterobactérias como Salmonella sp. e E. coli. tendo uma alta afinidade pela molécula do MOS.
Com isso, antes de se ligarem à mucosa intestinal, podem se aderir ao MOS presente no lúmen intestinal sendo assim eliminada junto ao bolo fecal (SHANE, 2001).

O MOS também pode aderir à mucosa intestinal, compondo uma barreira física de proteção que impede a colonização por microrganismos nocivos ao animal, proporcionando uma melhora na saúde e desempenho de animais.
Em adição a estes mecanismos, assim como ocorre com os β-glucanos, há evidências de que o MOS apresenta capacidade para induzir ativação de macrófagos por ocupar sítios receptores de manose nas glicoproteínas da superfície celular do macrófago (SILVA, 2006).
De acordo com Silva, et al., (2010), quando três ou mais destes sítios estão ocupados, inicia-se uma ativação da resposta imune adquirida que é caracterizada por uma reação em cascata que culmina na ativação dos macrófagos e na liberação de citocinas.
Assim, o MOS é capaz de aumentar os níveis de anticorpos circulantes específicos e a síntese de imunoglobulinas secretórias em resposta à exposição a antígenos (SAVAGE et al., 1997), sendo, na prática, efetivo no aumento de título vacinal, o que otimiza o efeito da vacinação e imunidade adquirida pelos animais imunizados.

Melhorias relacionadas à integridade intestinal dos frangos de corte e de aves de postura têm sido relatadas em estudos realizados pela Aleris utilizando o MAXIMOS (parede celular de S. cerevisiae).
![]() Em um experimento desenvolvido a campo com poedeiras comerciais, aquelas que consumiram as dietas contendo 1kg/t de MAXIMOS demonstraram diferença significativa (P<0,001) na diminuição da incidência de ovos quebrados e sujos em comparação ao grupo que consumiu dietas contendo um pool de probióticos. A porcentagem de bandejas de ovos que receberam a nota como zero de sujidade no tratamento com MAXIMOS foi 82% maior do que o tratamento com os probióticos (Gráfico 1).
Em um experimento desenvolvido a campo com poedeiras comerciais, aquelas que consumiram as dietas contendo 1kg/t de MAXIMOS demonstraram diferença significativa (P<0,001) na diminuição da incidência de ovos quebrados e sujos em comparação ao grupo que consumiu dietas contendo um pool de probióticos. A porcentagem de bandejas de ovos que receberam a nota como zero de sujidade no tratamento com MAXIMOS foi 82% maior do que o tratamento com os probióticos (Gráfico 1).
A capacidade do MOS em ampliar a área de absorção intestinal (ZAFAR et al., 2004), preservando as vilosidades pela diminuição da contaminação por patógenos e estímulo da microbiota benéfica, é um reflexo da saúde intestinal e melhor taxa de passagem verificadas neste experimento.



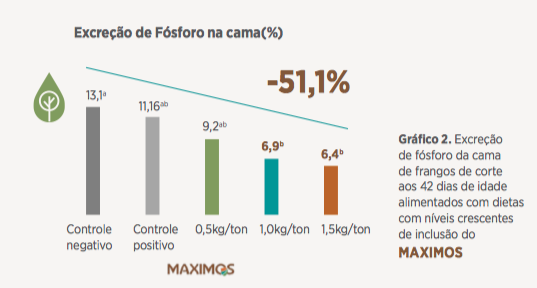
Neste mesmo experimento houve uma diminuição expressiva da excreção de fósforo na cama (Gráfico 2; – 51,1% para o nível de 1,5kg/t de Maximos) que segundo Fornazier et al., 2017 sinaliza uma melhora da saúde intestinal e melhor aproveitamento de nutrientes.
Com estes resultados, entende-se que o uso de parede celular como o MAXIMOS em dietas livres de antibióticos promotores de crescimento, que já é uma realidade no Brasil, assume uma função auxiliar no enfrentamento dos desafios entéricos e de ambiência comumente presentes nas criações.
A associação deste aditivo com outros de eficácia comprovada como acidificantes, fitoterápicos, probióticos, dentre outros, sustenta o status de saúde do animal e, consequentemente, seu desempenho. Entender as características e funcionalidade de cada aditivo é fundamental para assertividade e geração de bons resultados entendendo as especificidades de cada cliente final.

O extrato da levedura é a fração resultante da lise celular, após centrifugação e remoção da parede celular (fração insolúvel).
Muito rico nutricionalmente, o extrato integral da levedura, Saccharomyces sp., é descrito por Caballero-Córdoba et al., (1997) como uma excelente opção proteica não convencional para nutrição animal (Figura 2) devido ao teor elevado de proteína bruta (em média 48%, de acordo com AOAC), presença de ácidos nucleicos (em média, 8%, de acordo com método de HEBERT et al., 1971), lipídeos (em média, 4%, extraídos de acordo com o procedimento de BLIGHT e DYER, 1959), cinzas (em média, 8%, de acordo com AOAC) e carboidratos totais, que correspondem aos açúcares simples, oligossacarídeos, polissacarídeos, e seus derivados metabólicos (carboidratos de cadeias mais simples que podem ser resultados do metabolismo da levedura), incluindo éteres metílicos com grupos redutores livres ou potencialmente livres, (em média, 33%, método colorimétrico de DUBOIS et al.1956).

Com base neste conhecimento, durante muitos anos os produtos à base de levedura foram considerados como fontes de nucleotídeos para a nutrição animal.
Entretanto, apenas o processo de lise celular não é capaz de fornecer uma fonte padronizada de nucleotídeos livres.
Ou seja, só porque a levedura contém ácidos nucleicos não significa que estão biodisponíveis.
![]() Para que de fato um derivado de levedura possa ser considerado uma fonte estabelecida de nucleotídeos livres, é necessário que se empregue um processo biotecnológico adicional, no qual ocorrerá a extração e purificação do RNA presente no extrato da levedura, acompanhado de uma hidrólise promovida pela adição de enzimas exógenas.
Para que de fato um derivado de levedura possa ser considerado uma fonte estabelecida de nucleotídeos livres, é necessário que se empregue um processo biotecnológico adicional, no qual ocorrerá a extração e purificação do RNA presente no extrato da levedura, acompanhado de uma hidrólise promovida pela adição de enzimas exógenas.
![]() O processo de purificação extrai preferencialmente o RNA presente no citoplasma, uma vez que as fitas de DNA, localizadas no núcleo, estão condensadas, tornando seu acesso muito restrito. (NELSON e COX, 2000).
O processo de purificação extrai preferencialmente o RNA presente no citoplasma, uma vez que as fitas de DNA, localizadas no núcleo, estão condensadas, tornando seu acesso muito restrito. (NELSON e COX, 2000).
Assim, embora haja na literatura diversos estudos que relatem a utilização de nucleotídeos e atribuem as melhoras observadas nos animais à presença destes compostos, muitas vezes não são claras as informações sobre a fonte e disponibilidade dos nucleotídeos o que dificulta o entendimento sobre os reais benefícios e efeitos destas moléculas nos animais.

![]()
Os nucleotídeos são compostos intracelulares de baixo peso molecular que participam de vários processos bioquímicos e reações metabólicas, além de serem os constituintes (subunidades) dos ácidos nucleicos DNA e RNA (NELSON e COX, 2000).
Um nucleotídeo é formado por três moléculas que variam entre o DNA e o RNA, sendo:
![]() Base nitrogenada: São estruturas cíclicas e há dois tipos: as purinas e as pirimidinas. Cada nucleotídeo no DNA contém uma de quatro possíveis bases nitrogenadas: adenina (A), guanina (G), citosina (C) e timina (T). A e G são purinas, o que revela que suas estruturas contêm dois anéis de carbono-nitrogênio unidos. C e T são pirimidinas e têm um único anel de carbono-nitrogênio. Os nucleotídeos de RNA também podem apresentar as bases A, G e C mas, em vez de T eles têm outra base pirimidina chamada uracila (U).
Base nitrogenada: São estruturas cíclicas e há dois tipos: as purinas e as pirimidinas. Cada nucleotídeo no DNA contém uma de quatro possíveis bases nitrogenadas: adenina (A), guanina (G), citosina (C) e timina (T). A e G são purinas, o que revela que suas estruturas contêm dois anéis de carbono-nitrogênio unidos. C e T são pirimidinas e têm um único anel de carbono-nitrogênio. Os nucleotídeos de RNA também podem apresentar as bases A, G e C mas, em vez de T eles têm outra base pirimidina chamada uracila (U).
![]() Grupo fosfato: Os nucleotídeos podem ter um único grupo fosfato, ou uma cadeia de até três grupos fosfato, ligados covalentemente ao carbono do açúcar.
Grupo fosfato: Os nucleotídeos podem ter um único grupo fosfato, ou uma cadeia de até três grupos fosfato, ligados covalentemente ao carbono do açúcar.
![]() Pentose: Um açúcar de cinco carbonos que faz a ligação entre a base nitrogenada e o grupamento fosfato. No DNA temos a desoxirribose e no RNA temos a ribose, que diferem apenas na presença ou ausência de um átomo de oxigênio (presente no RNA).
Pentose: Um açúcar de cinco carbonos que faz a ligação entre a base nitrogenada e o grupamento fosfato. No DNA temos a desoxirribose e no RNA temos a ribose, que diferem apenas na presença ou ausência de um átomo de oxigênio (presente no RNA).
O nucleosídeo é formado apenas pela base nitrogenada e a pentose, sem a ocorrência do grupo fosfato. A inosina é um exemplo de nucleosídeo que pertence ao grupo das purinas. Este nucleosídeo é formado pela ligação da hipoxantina a uma ribose (pentose).
Esta molécula é comumente encontrada em fitas de tRNA. O tRNA é originado a partir do processo de transcrição do DNA, sendo responsável por transportar os aminoácidos para a síntese proteica (NELSON e COX, 2000; RAVEN et al., 2014).
![]() Os nucleotídeos estão naturalmente presentes em concentrações variadas em alimentos de origem animal e vegetal (CLIFFORD e STORY, 1976), não sendo considerados essenciais ao animal por serem naturalmente sintetizados pelo organismo.
Os nucleotídeos estão naturalmente presentes em concentrações variadas em alimentos de origem animal e vegetal (CLIFFORD e STORY, 1976), não sendo considerados essenciais ao animal por serem naturalmente sintetizados pelo organismo.
No entanto, hoje em dia, com os progressos em genética e ambiência para o máximo desempenho e, em determinadas fases em que o crescimento é acelerado ou o consumo de alimentos é insuficiente para atender as necessidades do animal, a suplementação de nucleotídeos é altamente recomendada para disponibilizar as bases nitrogenadas e nucleosídeos para serem utilizadas diretamente pelo organismo, economizando energia e/ou nutrientes adicionais que poderiam ser direcionados para outras funções.
Para que os nucleotídeos presentes nos ácidos nucleicos de ingredientes adicionados à dieta sejam absorvidos, é necessário que, primeiro, estes sejam hidrolisados em nucleosídeos no lúmen intestinal por ação de enzimas como as nucleases pancreáticas e fosfatases intestinais. (QUAN e UAUY, 1991).
 São poucos os estudos que elucidam a forma de absorção e utilização de nucleotídeos exógenos. Sugere-se que em condições fisiológicas, os nucleotídeos possuem uma capacidade limitada para atravessar as membranas celulares no intestino. Segundo Sanderson e He (1994) isto pode ser devido à ausência de um sistema de transporte de nucleotídeos ativos e também pela presença do grupo fosfato (PO-4) que possui carga negativa o que os impede de serem absorvidos, supondo-se que os nucleosídeos (nucleotídeo sem o grupo fosfato) seriam mais efetivos na absorção.
São poucos os estudos que elucidam a forma de absorção e utilização de nucleotídeos exógenos. Sugere-se que em condições fisiológicas, os nucleotídeos possuem uma capacidade limitada para atravessar as membranas celulares no intestino. Segundo Sanderson e He (1994) isto pode ser devido à ausência de um sistema de transporte de nucleotídeos ativos e também pela presença do grupo fosfato (PO-4) que possui carga negativa o que os impede de serem absorvidos, supondo-se que os nucleosídeos (nucleotídeo sem o grupo fosfato) seriam mais efetivos na absorção.
Entretanto, por hidrólise parcial é possível retirar o radical fosfato dos nucleotídeos, não sendo este o fator determinante do aproveitamento pelo animal (NELSON e COX, 2000).
Também, pressupõe-se que há uma diferença no aproveitamento entre as bases purinas e pirimidinas pelo organismo, sendo que o intestino desempenha um papel importante na definição do destino metabólico das purinas da dieta e pouco é relatado sobre a regulação do metabolismo da pirimidina pelo enterócito.
Em uma revisão de Uauy et al., (1994) os autores relatam que a diferença entre purinas e pirimidinas está mais na forma como estas são metabolizadas do que de fato absorvidas.

Desta forma, a diferença na quantidade das bases presentes em um ingrediente parece não apresentar diferenças de aproveitamento pelo animal, uma vez que tanto os nucleosídeos como apenas as bases são absorvidas pelo intestino (QUAN e UAUY, 1991) e desempenham seu papel nas vias metabólicas.

De forma geral, no organismo animal, os nucleotídeos são sintetizados por duas vias metabólicas, a síntese de novo que ocorre em várias etapas, sendo um processo metabolicamente caro, em termos energéticos, por isso exige quantidades substanciais de energia na forma de ATP (CARVER et al., 1995) e a via de salvamento, que recicla as bases livres e os nucleosídeos liberados a partir da degradação de ácidos nucleicos (NELSON e COX, 2000).
Sob condições de alimentação regular, a via de salvamento recicla 90% ou mais das bases de purina.

![]() Além disso, alguns tecidos têm capacidade limitada para realizar a via de síntese de novo de nucleotídeos, exigindo bases fornecidas exogenamente que podem ser utilizadas pela via de salvamento (SAVAIANO e CLIFFORD, 1981).
Além disso, alguns tecidos têm capacidade limitada para realizar a via de síntese de novo de nucleotídeos, exigindo bases fornecidas exogenamente que podem ser utilizadas pela via de salvamento (SAVAIANO e CLIFFORD, 1981).
Por exemplo, a mucosa intestinal, as células hematopoiéticas da medula óssea, leucócitos, eritrócitos e linfócitos são incapazes de realizar a via de síntese de novo (SANDERSON e HE, 1994) e, assim, utilizam a via de salvamento o que sugere que uma suplementação de nucleotídeos via dieta pode ser importante para essas células (COSGROVE, 1998).
Particularmente na mucosa intestinal, por ser um local de intenso turnover celular e, consequentemente, um alto gasto metabólico, a suplementação de nucleotídeos na dieta apresentam uma função significativa para a manutenção e otimização das atividades celulares.


Apesar dos nucleotídeos serem sintetizados endogenamente, a sua suplementação dietética pode exercer efeitos benéficos aos animais com ação no crescimento e desenvolvimento intestinal (WU et al., 2018) e estímulo a irrigação do tecido intestinal (BUSTAMANTE, 1990), além de acelerar a mitose e diminuir a apoptose dos enterócitos, devido à ausência (SAVAIANO e CLIFFORD, 1981) ou limitação (LELEIKO et al.,1983) da síntese de novo.
![]() Os efeitos descritos na literatura são na melhora da estrutura intestinal (MARTINEZ-PUIG et al.,2007), na proliferação celular (SATO et al., 1999), mas também na indução das enzimas intestinais (ORTEGA e SA´NCHEZ-POZO, 1995) e na recuperação de períodos pós-infecções em que se exige um maior conteúdo de DNA intestinal (UAUY et al., 1990).
Os efeitos descritos na literatura são na melhora da estrutura intestinal (MARTINEZ-PUIG et al.,2007), na proliferação celular (SATO et al., 1999), mas também na indução das enzimas intestinais (ORTEGA e SA´NCHEZ-POZO, 1995) e na recuperação de períodos pós-infecções em que se exige um maior conteúdo de DNA intestinal (UAUY et al., 1990).

Um papel protetor também foi relatado por Martinez-Puig et al. (2007) na prevenção da diarreia em suínos, sendo que uma possível explicação é justamente a modulação da composição da microbiota fecal, por meio de um aumento da abundância dos gêneros favoráveis ao desempenho do animal (WU et al., 2018).
Outra função atribuída por Silva et al. (2013) aos nucleotídeos foi sua habilidade em promover taxas ótimas de divisão celular na epiderme, uma vez que garantem a rápida recuperação de qualquer dano a pele, e possuem capacidade de proteger as camadas subjacentes de danos, desidratação e patógenos, pois em um estudo utilizando ratos que receberam nucleotídeos de adenosina (principalmente ATP e ADP) houve evidências de que a presença destes nucleotídeos foi capaz de atenuar a resposta inflamatória dos animais com dermatite e acelerar a sua recuperação.
![]() Hoje em dia, com problemas de pele observados nas linhagens modernas de frango de corte e que exigem uma alta taxa de renovação e recuperação celular, a inclusão de nucleotídeos purificados na dieta pode ser um coadjuvante para mitigar estas enfermidades.
Hoje em dia, com problemas de pele observados nas linhagens modernas de frango de corte e que exigem uma alta taxa de renovação e recuperação celular, a inclusão de nucleotídeos purificados na dieta pode ser um coadjuvante para mitigar estas enfermidades.

Baseado nos benefícios dos nucleotídeos, no conhecimento da riqueza do extrato de levedura e no empenho e esforço em se obter um produto que garanta nucleotídeos livres, a ALERIS, após anos de aprimoramento, apresenta em sua linha de produtos o NUCLEOBASE 1.5.
Este produto é originado do extrato de levedura que passa por um processo biotecnológico de purificação e hidrólise do RNA, incluindo, para a sua padronização, a levedura autolisada, com a garantia de uma quantidade mínima de 15% de nucleotídeos livres no produto final.


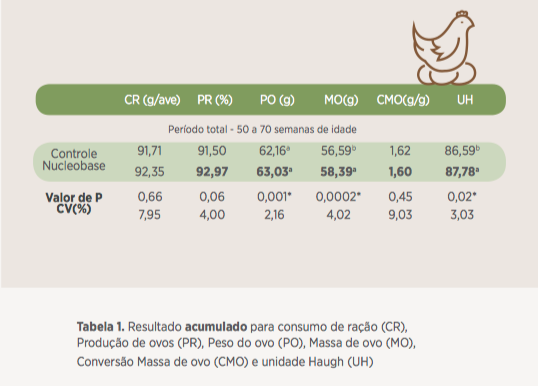
Ao final do período experimental as aves apresentaram melhora expressiva para taxa de postura (93% de postura, em média), peso do ovo (63 gramas, em média), deposição de massa de ovo (58 gramas/ave/dia, em média) e unidade Haugh (87,8 em média) quando alimentadas com dietas suplementadas com 500g/t de Nucleobase 1.5.
![]() Estes resultados indicam que o Nucleobase 1.5 foi capaz de melhorar a deposição proteica no ovo e melhorar a qualidade da proteína depositada.
Estes resultados indicam que o Nucleobase 1.5 foi capaz de melhorar a deposição proteica no ovo e melhorar a qualidade da proteína depositada.


![]()
Assine agora a revista técnica de nutrição animal
AUTORES

Impactos dos microminerais essenciais na alimentação de aves e suínos
Simone Gisele de Oliveira
Modulação do metabolismo da vitamina D em leitões desmamados
Jérôme Lapointe
Alimentação de poedeiras de ciclo longo
Manuel Vázquez
Colostragem e seu impacto na produção de bovinos
Maria Luiza Fischer
Formulação de ração para monogástricos
Emanuel Isaque Cordeiro da Silva
A Indústria de Rendering: sustentabilidade e nutrição animal
Lucas Cypriano
Ação sinérgica de fitase e estimbiótico na qualidade óssea de frangos
Miliane Alves da Costa
E.C.O.Trace® Minerais organicamente ligados

Uso de pó secante à base de fitoativos para o bem-estar da leitegada
Gabriela Miotto Galli