|
Las micotoxinas representan un desafío importante para la producción animal, estando su prevalencia en las materias primas o piensos sujeta a variaciones relacionadas con cambios en las condiciones climáticas. Por ejemplo, las sequías o años con alta pluviometría afectan el tipo de hongos que proliferan en ciertas regiones (Moretti et al., 2019) |
Existen diferentes métodos para controlar el impacto de las micotoxinas en la producción animal, desde el control de su presencia en las materias primas durante la precosecha y postcosecha, hasta la detoxificación de los animales expuestos a ellas a través de dietas contaminadas. 
La utilización de adsorbentes de micotoxinas (ADS) está ampliamente reconocida como una estrategia eficaz para minimizar los efectos de las micotoxinas en animales contaminados (Galvano et al., 2001).
![]() Los adsorbentes de micotoxinas son activos en el tracto gastrointestinal de los animales, fijándose las micotoxinas a la matriz del adsorbente mediante diferentes interacciones fisicoquímicas.
Los adsorbentes de micotoxinas son activos en el tracto gastrointestinal de los animales, fijándose las micotoxinas a la matriz del adsorbente mediante diferentes interacciones fisicoquímicas.
Existen diferentes tipos de adsorbentes, siendo los más comunes las arcillas, el carbón activado (CA) y la pared celular de levadura (LEV), cuyo espacio interlaminar, los poros y los β-glucanos representan sus factores de adsorción clave, respectivamente (Jouany, 2007).
| Para determinar la eficacia de los adsorbentes de micotoxinas se recurre, principalmente, a pruebas in vitro que permiten la evaluación de un amplio número de adsorbentes y micotoxinas con la ventaja de ser comparación con las pruebas in vivo. |
Sin embargo, existen muchas variantes de las pruebas in vitro que se han desarrollado al cabo de años intentando simular los procesos del tracto gastrointestinal de los animales.
El problema de estos métodos es la alta variabilidad de los resultados de adsorción de micotoxinas.
| Estos protocolos varían en complejidad, desde una prueba simple con agua destilada e incubación a temperatura ambiente (Lemke et al., 2001) hasta métodos más complejos que simulan los procesos del tracto gastrointestinal de los animales utilizando diferentes pH e incluyendo enzimas gastrointestinales, o utilizando jugo gástrico como medio de incubación (Avantaggiato et al., 2004; Gallo y Masoero, 2010). |

Desafortunadamente, esta diversidad de protocolos experimentales ha resultado en una alta variabilidad en los resultados de la capacidad de adsorción de los adsorbentes (Kihal et al., 2022).
DISCUSIÓN COMPARATIVA SOBRE LA CAPACIDAD DE ADSORCIÓN DE LOS ADSORBENTES ENTRE ESTUDIOS IN VITRO E IN VIVO
Determinar la capacidad de adsorción de micotoxinas en pruebas in vivo es imprescindible para demostrar la eficacia real del producto.
| Al contrario que las pruebas in vitro, las pruebas in vivo replican las condiciones del campo y la respuesta del animal al suplemento de los adsorbentes en presencia de micotoxinas en las dietas. |

Para arrojar más luz sobre la concordancia de resultados de estudios in vitro e in vivo, se llevó a cabo un estudio de metaanálisis en red sobre datos publicados en la literatura de estudios que hayan evaluado la eficacia de diferentes adsorbentes para reducir la concentración de aflatoxina M1 (AFM1) y su transferencia del alimento a la leche después de desafiar a las vacas lecheras con AFB1 (Kihal et al., 2023).
El hallazgo clave de este estudio fue que la eficacia de las diferentes fuentes de adsorbentes [carbón activado (CA), bentonita, aluminosilicatos (HSCAS), pared celular de levaduras (LEV) y una mezcla de adsorbentes (MIX)] redujo significativamente el porcentaje de AFM1 en la leche en comparación con el control.
![]() Estos resultados confirman la eficacia de los adsorbentes para adsorber aflatoxinas a partir de ensayos in vitro, aunque el porcentaje de adsorción in vivo fue menor. Además, el porcentaje de reducción entre diferentes adsorbentes in vivo no fue diferente, lo que demuestra un efecto similar entre los diferentes adsorbentes.
Estos resultados confirman la eficacia de los adsorbentes para adsorber aflatoxinas a partir de ensayos in vitro, aunque el porcentaje de adsorción in vivo fue menor. Además, el porcentaje de reducción entre diferentes adsorbentes in vivo no fue diferente, lo que demuestra un efecto similar entre los diferentes adsorbentes.
Es importante señalar que el número de estudios in vivo fue inferior al número de estudios in vitro incluidos en este metaanálisis (28 frente a 68 artículos).
![]() Esta diferencia puede tener un efecto sobre la variabilidad de los resultados que conducen a una alta variabilidad entre las comparaciones de tratamientos.
Esta diferencia puede tener un efecto sobre la variabilidad de los resultados que conducen a una alta variabilidad entre las comparaciones de tratamientos.
Retos y limitaciones de los estudios in vivo
Los estudios in vivo, a diferencia de las pruebas in vitro, son complicados, costosos y difíciles de aplicar:
![]() Requieren la aplicación de protocolos de bioseguridad para manipular micotoxinas a nivel de granja.
Requieren la aplicación de protocolos de bioseguridad para manipular micotoxinas a nivel de granja.
![]() Las instalaciones requeridas no están disponibles en la mayoría de los centros de investigación.
Las instalaciones requeridas no están disponibles en la mayoría de los centros de investigación.
Además, al igual que en las pruebas in vitro, los estudios in vivo se deben realizar bajo condiciones experimentales para evitar resultados engañosos.
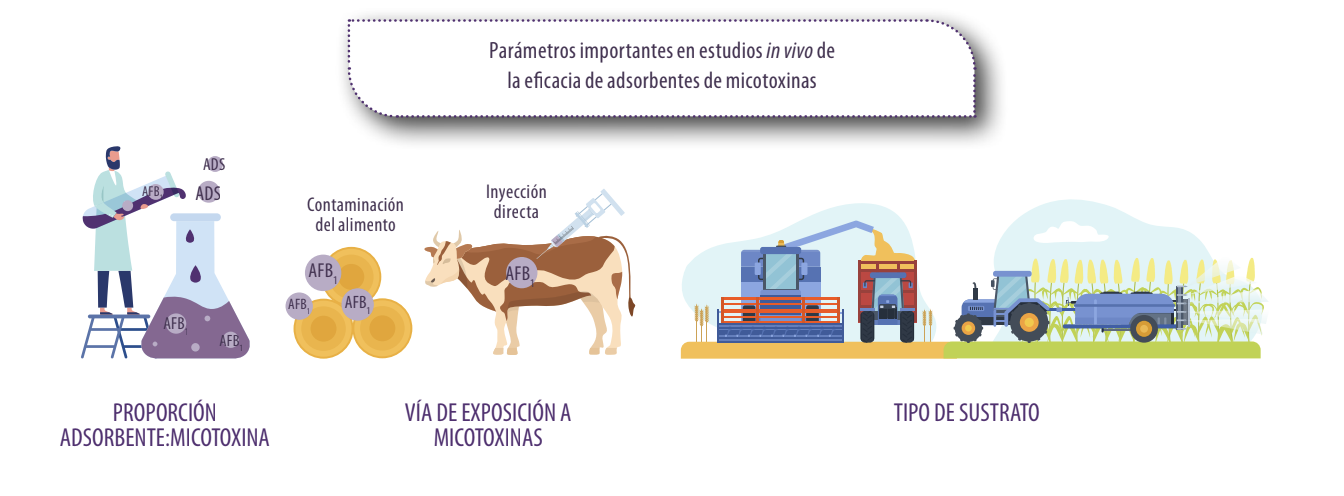
 Definir la dosis de adsorbente: micotoxina es un problema común en estudios in vitro e in vivo, ya que trabajar con las proporciones inadecuadas puede favorecer o desfavorecer los resultados de adsorción de la micotoxina.
Definir la dosis de adsorbente: micotoxina es un problema común en estudios in vitro e in vivo, ya que trabajar con las proporciones inadecuadas puede favorecer o desfavorecer los resultados de adsorción de la micotoxina.
La forma de contaminar el alimento en los trabajos experimentales también es un factor clave en la evaluación de la capacidad de adsorción.
Por ejemplo, la suplementación de alimentos naturalmente contaminados puede afectar los resultados en comparación con la suplementación de AFB1 pura directamente en el rumen de la vaca.
![]() Esto se debe a que el alimento naturalmente contaminado puede contener diferentes tipos de aflatoxinas (AFB1, AFB2, AFG1 o AFG2) u otras micotoxinas, dando como resultado fenómenos de sinergia o de competencia por la unión al adsorbente testado.
Esto se debe a que el alimento naturalmente contaminado puede contener diferentes tipos de aflatoxinas (AFB1, AFB2, AFG1 o AFG2) u otras micotoxinas, dando como resultado fenómenos de sinergia o de competencia por la unión al adsorbente testado.
La materia prima utilizada para el desarrollo del hongo es muy importante, ya que los hongos utilizan los nutrientes del grano contaminado para su crecimiento y usar diferentes tipos de granos también puede afectar el desarrollo del hongo y la producción de micotoxinas.
| Aun así, los experimentos in vivo son el mejor método para probar la eficacia de los adsorbentes y permiten tener una comprensión más profunda del funcionamiento de los productos en los animales. |
El trabajo revisión de los resultados de los estudios in vitro e in vivo de los adsorbentes (Kihal et al., 2023) permitió confirmar que su capacidad de adsorción de aflatoxinas in vitro fue similar a los experimentos in vivo donde diferentes adsorbentes (carbón activado, bentonita y HSCAS) disminuyeron con éxito la concentración de AFM1 en leche en un rango de 26-45%.
![]() En cambio, la LEV mostró la capacidad de adsorción más baja en las pruebas in vitro, lo que concuerda con las pruebas in vivo en la que la fue el adsorbente menos eficaz para reducir la transferencia de AFM1 en leche.
En cambio, la LEV mostró la capacidad de adsorción más baja en las pruebas in vitro, lo que concuerda con las pruebas in vivo en la que la fue el adsorbente menos eficaz para reducir la transferencia de AFM1 en leche.
Cabe reseñar que el uso de los adsorbentes in vivo resultó en una menor capacidad de adsorción en comparación con los resultados in vitro, con una disminución de más del 50% para el CA, la bentonita y la LEV, y una disminución del 67% para HSCAS.
A este respecto, se sugiere que, bajo las condiciones in vivo, el contenido del tracto gastrointestinal (enzimas, nutrientes, bacterias) interfiere y compite con las micotoxinas por los sitios de adsorción de los adsorbentes, lo que conduce a una disminución de la capacidad general, lo que contrasta con las condiciones in vitro donde los medios de incubación contienen menos moléculas orgánicas. |
¿CUÁL ES EL POTENCIAL DE LOS ADSORBENTES DE MICOTOXINAS DE INTERFERIR CON LA ADSORCIÓN DE OTROS NUTRIENTES Y CUÁL ES LA MEJOR HERRAMIENTA PARA COMPROBARLO, IN VITRO O IN VIVO?
Estudios recientes en nuestro laboratorio han demostrado que la capacidad de adsorción de los adsorbentes de micotoxinas se ve afectada por:
→ El tipo de adsorbente.
→ La micotoxina.
→ Las características del medio de incubación.
(Kihal et al., 2022)
Además, esta capacidad podría verse alterada por la interacción de nutrientes presentes en el mismo ambiente con micotoxinas, tanto in vivo como in vitro.
|
El mecanismo de adsorción de los adsorbentes no es selectivo para unirse solamente a micotoxinas, sino que también pueden adsorber otras moléculas presentes en el tracto gastrointestinal del animal, como los nutrientes. Esta capacidad de unirse a nutrientes se atribuye a las similitudes fisicoquímicas de algunos nutrientes con las micotoxinas que permiten su interacción. |
Estudios in vitro sobre la capacidad de adsorción de nutrientes
La capacidad de los adsorbentes para adsorber nutrientes se ha estudiado utilizando modelos in vitro.
|
→ Kihal et al. (2020; 2021) estudiaron la interacción de seis diferentes adsorbentes con aminoácidos y vitaminas: Los autores señalaron un rango de adsorción del 27-37% para aminoácidos, del 25-58% para vitaminas hidrosolubles y del 10-29% para vitaminas liposolubles. → Vekiru et al. (2007) también observaron que el CA adsorbía una gran proporción de vitamina B8 (78%) y B12 (99%), mientras que la bentonita tenía menor adsorción de vitamina B12 (47%). → Barrientos-Velázquez et al. (2016) reportaron que la bentonita absorbió el 34% de la vitamina B1 y que, paralelamente, la adsorción de aflatoxinas se redujo en un 34%, lo que indica una competencia directa de otros nutrientes por los sitios de adsorción. → Mortland et al. (1983) reportaron que la esméctica tiene capacidad de adsorber vitamina B2 (50%). → También se ha observado que la bentonita y la montmorillonita adsorben proteínas en un modelo in vitro (Ralla et al., 2010; Barrientos-Velázquez et al., 2016). → La capacidad de los adsorbentes para adsorber minerales también fue investigada in vitro por Tomasevic- Canovic et al. (2001) que observaron una alta capacidad de la bentonita para adsorber cobre (56%) y cobalto (73%), mientras que la adsorción de zinc (12%) y manganeso (12%) fue relativamente baja. |

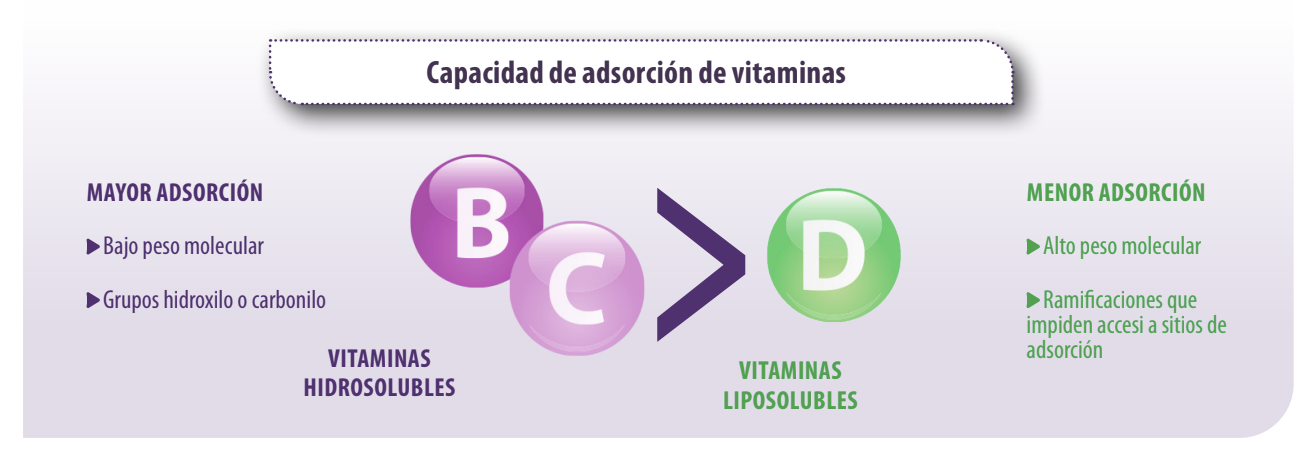
En cambio, las vitaminas A, D, B3, B5 y B8, y los aminoácidos, triptófano y fenilalanina, no fueron adsorbidos por la bentonita y la zeolita (Tomasevic-Canovic et al., 2001; Vekiru et al.,2007; Kihal et al., 2020).
Estos resultados se atribuyeron principalmente a las propiedades fisicoquímicas de cada nutriente.
![]() La capacidad de adsorción de las vitaminas hidrosolubles fue mayor debido a su bajo peso molecular y a la presencia de más de un grupo hidroxilo o carbonilo que asegura una adsorción estable con los adsorbentes.
La capacidad de adsorción de las vitaminas hidrosolubles fue mayor debido a su bajo peso molecular y a la presencia de más de un grupo hidroxilo o carbonilo que asegura una adsorción estable con los adsorbentes.
![]() La adsorción de vitamina D fue menor debido al mayor peso molecular y la presencia de diferentes ramificaciones que impiden su entrada en los sitios de adsorción del adsorbente.
La adsorción de vitamina D fue menor debido al mayor peso molecular y la presencia de diferentes ramificaciones que impiden su entrada en los sitios de adsorción del adsorbente.
A pesar de estos resultados, existen problemas técnicos a la hora de aplicar estos métodos en algunos nutrientes, ya que algunos de ellos son sensibles a factores ambientales y pueden sufrir alteraciones durante la incubación.
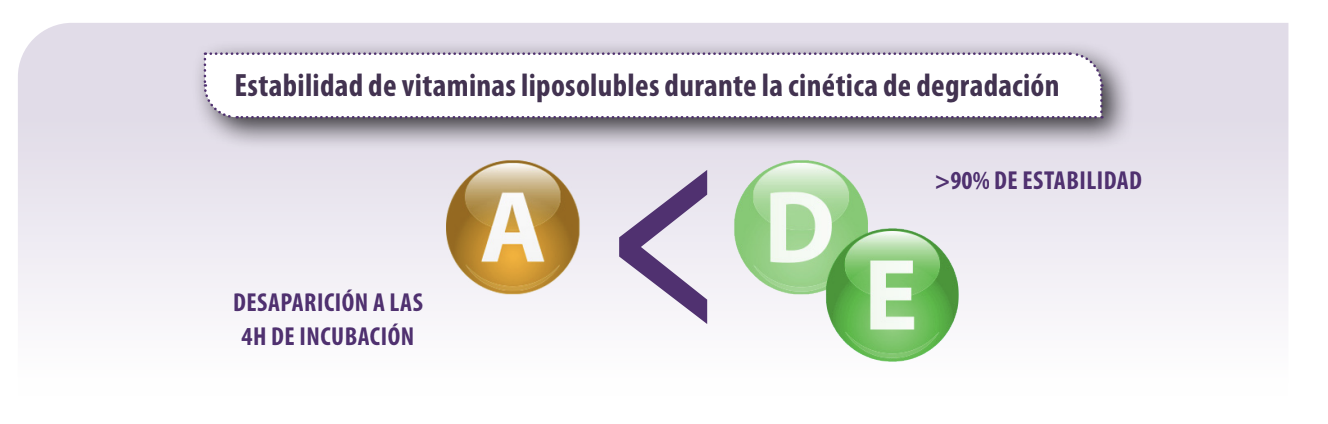
![]() Kihal et al. (2021) observaron que la vitamina A desaparecía del medio de incubación a las 4 horas de incubación lo que no permite su valoración, mientras que las vitaminas D y E fueron más estables durante la cinética de degradación y mostraron más del 90% de estabilidad.
Kihal et al. (2021) observaron que la vitamina A desaparecía del medio de incubación a las 4 horas de incubación lo que no permite su valoración, mientras que las vitaminas D y E fueron más estables durante la cinética de degradación y mostraron más del 90% de estabilidad.
![]() Díaz et al. (2004) señalaron que los resultados de las pruebas in vitro no deben considerarse como resultados finales y sugirieron que se deben realizar estudios in vivo para tener resultados más fiables.
Díaz et al. (2004) señalaron que los resultados de las pruebas in vitro no deben considerarse como resultados finales y sugirieron que se deben realizar estudios in vivo para tener resultados más fiables.
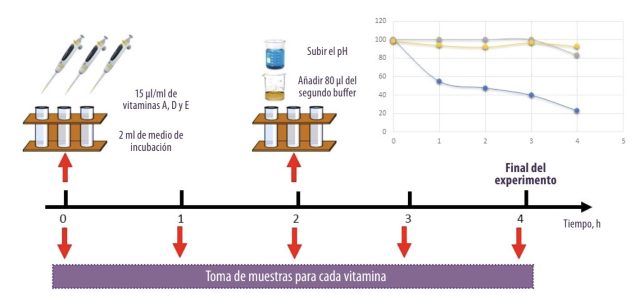
Figura 1. Evaluación de la estabilidad de vitaminas liposolubles en el medio de incubación.

Estudios in vivo sobre la capacidad de adsorción de nutrientes
La biodisponibilidad de los nutrientes en presencia de adsorbentes de micotoxinas también se ha estudiado in vivo.
 Briggs y Fox (1956) observaron que la suplementación de las dietas de los pollos con 2-3% de bentonita resultaba en una deficiencia de vitamina A.
Briggs y Fox (1956) observaron que la suplementación de las dietas de los pollos con 2-3% de bentonita resultaba en una deficiencia de vitamina A.
 El contenido de zinc también disminuyó en los huesos de pollos después de que se suplementaron con HSCAS del 0,5 al 1% de la dieta (Chung et al., 1989).
El contenido de zinc también disminuyó en los huesos de pollos después de que se suplementaron con HSCAS del 0,5 al 1% de la dieta (Chung et al., 1989).
 En cambio, Afriyie-Gyawu (2004) y Pimpukdee et al. (2004) observaron que la inclusión de 0,5% de bentonita no afectaba la concentración de vitamina A en el hígado y Chung et al. (1989) encontraron que la inclusión de HSCAS no afectaba a la biodisponibilidad de vitamina A, vitamina B2 y manganeso en pollitos.
En cambio, Afriyie-Gyawu (2004) y Pimpukdee et al. (2004) observaron que la inclusión de 0,5% de bentonita no afectaba la concentración de vitamina A en el hígado y Chung et al. (1989) encontraron que la inclusión de HSCAS no afectaba a la biodisponibilidad de vitamina A, vitamina B2 y manganeso en pollitos.
 Sulzberger et al. (2016) y Kihal et al. (2022), tras suplementar vacas lecheras con 1,2 y 2% de montmorillonita en la dieta de vacas lecheras, tampoco observaron cambios en la concentración plasmática de vitaminas A, D, E, B1 y B6.
Sulzberger et al. (2016) y Kihal et al. (2022), tras suplementar vacas lecheras con 1,2 y 2% de montmorillonita en la dieta de vacas lecheras, tampoco observaron cambios en la concentración plasmática de vitaminas A, D, E, B1 y B6.

 Maki et al. (2016) suplementaron HSCAS a vacas lecheras al 1,2% de la materia seca de la dieta y no observaron efectos negativos en la biodisponibilidad de las vitaminas A y B2 en la leche.
Maki et al. (2016) suplementaron HSCAS a vacas lecheras al 1,2% de la materia seca de la dieta y no observaron efectos negativos en la biodisponibilidad de las vitaminas A y B2 en la leche.
![]() Estos resultados podrían sugerir que las pruebas in vitro no son del todo fiables y debemos ser muy conservadores cuando nos referimos a tales resultados.
Estos resultados podrían sugerir que las pruebas in vitro no son del todo fiables y debemos ser muy conservadores cuando nos referimos a tales resultados.
RECOMENDACIONES PARA MEJORAR LA PRECISIÓN DE LAS PRUEBAS IN VITRO E IN VIVO
Proporciones estandarizadas de adsorbente: micotoxina
Además de los factores que limitan la interacción específica entre los adsorbentes y las micotoxinas, el mecanismo de adsorción de los adsorbentes es saturable y depende del número de sitios de adsorción disponibles para las micotoxinas en la matriz.
Por esta razón, la proporción de adsorbente:micotoxina es un factor esencial de las pruebas in vitro donde la capacidad de adsorción y puede manipularse fácilmente:
![]() Concentración alta de adsorbente y Concentración baja de micotoxinas: la incubación de una concentración alta de adsorbente con una concentración baja de micotoxinas conducirá a una mayor capacidad de adsorción de los adsorbentes probados porque hay más sitios de adsorción disponibles que micotoxinas presentes en el medio.
Concentración alta de adsorbente y Concentración baja de micotoxinas: la incubación de una concentración alta de adsorbente con una concentración baja de micotoxinas conducirá a una mayor capacidad de adsorción de los adsorbentes probados porque hay más sitios de adsorción disponibles que micotoxinas presentes en el medio.
![]() Concentración baja de adsorbente y Concentración alta de micotoxinas: la incubación de una dosis baja de adsorbente con una dosis alta de micotoxinas conducirá a una menor capacidad de adsorción debido a la saturación de los sitios de adsorción disponibles en los adsorbentes.
Concentración baja de adsorbente y Concentración alta de micotoxinas: la incubación de una dosis baja de adsorbente con una dosis alta de micotoxinas conducirá a una menor capacidad de adsorción debido a la saturación de los sitios de adsorción disponibles en los adsorbentes.
(Sulzberger et al., 2017)
| Utilizando los datos seleccionados para el análisis de la eficacia de los adsorbentes in vitro, las proporciones de adsorbente:micotoxina utilizados en las técnicas actuales dieron como resultado un rango muy amplio de proporciones independientemente del tipo de micotoxina o adsorbente (1:0,00007 a 1:600 mg/μg, Tabla 1). |
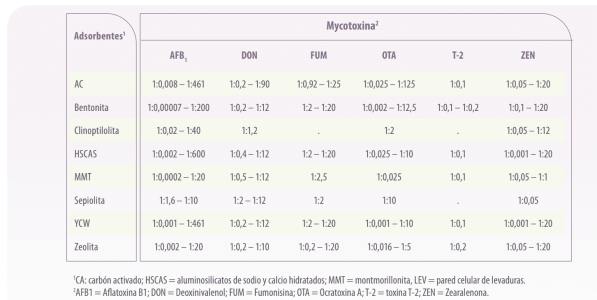
Tabla 1. Rangos de la ratio de adsorbentes de micotoxinas y micotoxinas (mg:μg) utilizados en las pruebas in vitro para determinar la capacidad de adsorción de diferentes micotoxinas y adsorbentes de micotoxinas.
Será relevante establecer una proporción estandarizada de adsorbente:micotoxina que deben utilizarse en las pruebas in vitro a fin de realizar comparaciones justas.
→ La EFSA (2017) considera que los adsorbentes son seguros y establecen dosis límites de seguridad altas (20 kg/t de pienso).
Las dosis recomendadas actualmente de adsorbente están establecidas generalmente por las empresas comercializadoras de los adsorbentes que realizan pruebas in vitro utilizando diferentes dosis de inclusión de adsorbentes.
![]() Esta dosis requerida difiere según el tipo del adsorbente, cambiando las propiedades químicas con la composición química y la naturaleza del adsorbente. Sin embargo, debería ser posible recomendar un rango de proporciones que deberían seguirse durante los experimentos in vitro.
Esta dosis requerida difiere según el tipo del adsorbente, cambiando las propiedades químicas con la composición química y la naturaleza del adsorbente. Sin embargo, debería ser posible recomendar un rango de proporciones que deberían seguirse durante los experimentos in vitro.
 Díaz et al. (2004) recomendaron una concentración de 1,2% de materia seca diaria de adsorbente equivalente a 300 g/día/vaca. Sin embargo, la ingesta diaria de micotoxinas es muy variable y depende del tipo de micotoxina.
Díaz et al. (2004) recomendaron una concentración de 1,2% de materia seca diaria de adsorbente equivalente a 300 g/día/vaca. Sin embargo, la ingesta diaria de micotoxinas es muy variable y depende del tipo de micotoxina.
Por ello, es razonable proponer una dosis adecuada relacionada con los niveles tóxicos mínimos de cada micotoxina evaluados por la Comisión Europea (CE, 2006 sobre materias primas).
Para estandarizar un protocolo in vitro, proponemos utilizar una relación adsorbente:micotoxina cercana a la encontrada en condiciones de campo.
![]() Con este objetivo se debe determinar la ingesta diaria de los adsorbentes y las micotoxinas.
Con este objetivo se debe determinar la ingesta diaria de los adsorbentes y las micotoxinas.
![]() La dosis práctica de adsorbentes se debe considerar en base a la que ha demostrado ser efectiva para adsorber micotoxinas.
La dosis práctica de adsorbentes se debe considerar en base a la que ha demostrado ser efectiva para adsorber micotoxinas.
Debido a que las micotoxicosis ocurren en animales con altas concentraciones de micotoxinas, proponemos utilizar la concentración tóxica mínima para cada micotoxina multiplicada por 10 para las pruebas in vitro.
Entonces, la ingesta diaria será 10 veces mayor que los límites tóxicos mínimos considerando un consumo promedio para cada especie animal.

Esta relación adsorbente:micotoxina (mg/μg) debería permitir evaluar la capacidad de los adsorber para adsorber niveles tóxicos de micotoxinas en una proporción adecuada.
Estandarización de las pruebas in vitro
Un procedimiento estandarizado también debe considerar otros aspectos, como las características y el volumen de los medios de incubación, la duración y el pH, entre otros.
Proceso de validación de las pruebas in vitro
Finalmente, como toda prueba in vitro, sería necesaria una validación.
Sin embargo, es muy difícil realizar pruebas in vivo para proporcionar datos suficientes de cada adsorbente y cada micotoxina para el proceso de validación, lo que aumenta la dificultad de desarrollar una prueba fiable y validada.
CONCLUSIONES
| Debido a la variabilidad en los resultados y los escasos datos disponibles, es importante: 1. Estandarizar un método in vitro para evaluarla capacidad de los adsorbentes de adsorber micotoxinas y otros nutrientes in vitro. 2. Validar los resultados con pruebas in vivo.Los protocolos in vitro reales que se utilizan para evaluar adsorbentes están diseñados como método de detección, usándose principalmente durante el desarrollo del producto porque brindan información rápida y económica sobre la eficacia de los productos.⇒ Sin embargo, esta información es limitada debido a la alta variabilidad entre métodos y laboratorios. |
El reto actual es desarrollar un nuevo método validado que proporcione resultados fiables para diferentes adsorbentes y micotoxinas.
![]() Un método validado también se puede utilizar como un procedimiento de refinamiento para reemplazar los estudios in vivo que son costosos y complicados de aplicar.
Un método validado también se puede utilizar como un procedimiento de refinamiento para reemplazar los estudios in vivo que son costosos y complicados de aplicar.
* Referencias disponibles a petición.
Artículo original de mycotoxinsite.com