Figura 1 . Modelo ADME aplicado a las micotoxinas
Para leer más contenidos de NutriNews Septiembre 2018
La dificultad para detectar la contaminación real por micotoxinas presente en las materias primas y piensos, debido a su distribución heterogénea, así como su habitual poca manifestación clínica específica, hace que muchos problemas de causa desconocida se atribuyan a ellas.
Para acabar con estos “actos de fe”, ya existe un método basado en biomarcadores que permite detectar las micotoxinas y sus metabolitos en hígado.
Este sistema permite obtener un diagnóstico fiable del problema, llevar un control sobre la situación en las explotaciones y valorar OBJETIVAMENTE la eficacia real que están teniendo los adsorbentes de micotoxinas en cada caso en particular.
La contaminación por micotoxinas es un problema inevitable dados los muchos factores que favorecen su síntesis, tanto en el campo como en el almacenamiento.
Sus repercusiones en la seguridad alimentaria ocasionan importantes pérdidas económicas que afectan además a todos los eslabones del sector de producción:
![]() a los agricultores
a los agricultores
![]() a los productores de piensos
a los productores de piensos
![]() y a los granjeros
y a los granjeros
Las micotoxinas producen en el organismo cambios fisiológicos que se traducen en una disminución del crecimiento, desarrollo y producción, pero la habitual inespecificidad de los signos clínicos hace que puedan ser confundidas con otras enfermedades e incluso con deficiencias de manejo o nutricionales.
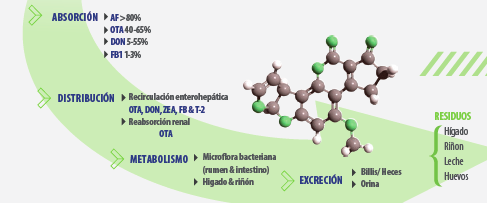
Las particularidades de las etapas de absorción, distribución, metabolización o biotransformación y excreción (sistema ADME) para cada una de las micotoxinas (ver figura 1) justifican los distintos grados de toxicidad y de sensibilidad de las diversas especies animales.
Figura 1 . Modelo ADME aplicado a las micotoxinas
ABSORCIÓN
Después de la ingesta (principal ruta, pero no única, de exposición a las micotoxinas), la absorción ocurre principalmente a nivel del tracto digestivo, por difusión pasiva.

CIRCULACIÓN
La circulación de las micotoxinas en el organismo también determina su grado de toxicidad.
![]() Micotoxinas con recirculación entero-hepática se segregan a través de la bilis al lumen intestinal, incrementando su tiempo de exposición y ejerciendo nuevamente su toxicidad sobre el tejido epitelial.
Micotoxinas con recirculación entero-hepática se segregan a través de la bilis al lumen intestinal, incrementando su tiempo de exposición y ejerciendo nuevamente su toxicidad sobre el tejido epitelial.
![]() En el caso de OTA, la reabsorción activa a nivel de los túbulos proximales del riñón retarda su eliminación, aumentando su vida media en sangre y acumulación en el tejido renal (Milićević, 2008).
En el caso de OTA, la reabsorción activa a nivel de los túbulos proximales del riñón retarda su eliminación, aumentando su vida media en sangre y acumulación en el tejido renal (Milićević, 2008).
METABOLISMO
El metabolismo o biotransformación es el mecanismo por el cual el organismo modifica los xenobióticos (compuesto ajeno al organismo), a través de las reacciones de FASE I (activación) y de FASE II (detoxificación).
![]()
En las micotoxinas esta biotransformación ocurre en el tracto digestivo por la acción de microorganismos (especialmente importante en rumiantes) y en hígado y riñón por acción enzimática.
La Zearalenona – ZEA – es metabolizada principalmente a α-ZEA y β-ZEA.
![]()
La forma α-ZEA tiene más afinidad por los receptores estrogénicos que la propia ZEA, mientras que el isómero β-ZEA está considerado como un metabolito de detoxificación (Goyart et al., 2007).
La ingesta de micotoxinas se relaciona con una transferencia hacia los órganos del animal (Goyarts et al., 2007; Khan et al., 2013; Petterson, 2004; Völkel et al., 2011). Pudiendo detectarse la propia micotoxina o sus metabolitos en tejidos, fluidos y productos de origen animal (leche y huevos).
Según Bryden (2012) y Völkel et al. (2011), los factores que determinan la metabolización/excreción, grado de transferencia y acumulación o deposición en tejidos son:
BIOMARCADORES
Los biomarcadores se definen como cambios o alteraciones celulares, biológicas o moleculares que se producen en los tejidos en respuesta a un xenobiótico, en este caso las micotoxinas (Turner et al., 1999; Mayeux, 2004; Garban et al., 2005; Baldwin et al., 2011; Silins y Högberg, 2011).
El estudio de los biomarcadores resulta de gran utilidad para proporcionar información sobre la exposición a dicho xenobiótico, los efectos producidos o la susceptibilidad del individuo.
Para establecer un biomarcador hacen falta numerosos estudios de toxicología y una validación exhaustiva que permita establecer, por ejemplo, una relación entre un biomarcador y la dosis externa o el grado de enfermedad.
Biomarcadores presentes en hígado que pueden ser utilizados para medir la exposición a las principales micotoxinas que afectan a los animales (fuente: adaptado de Baldwin et al., 2011).

Según la secuencia de eventos que se produce desde la exposición hasta el desarrollo de la enfermedad, los biomarcadores pueden clasificarse, según el Committe on Biological Markers of the National Research Council, 1987), en :
Los biomarcadores de exposición miden la dosis interna (micotoxina absorbida) mediante el análisis de la micotoxina o alguno de sus metabolitos mientras que los biomarcadores de efecto miden cambios estructurales o funcionales producidos en el organismo tras la exposición a la micotoxina. Sin embargo, estos cambios pueden servir como biomarcadores de exposición cuando ambos procesos están directamente ligados.
La matriz biológica de estudio determina el tiempo de exposición a la micotoxina reflejado por un biomarcador.
En sangre, los niveles de micotoxinas reflejan un corto período de tiempo de exposición (unas pocas horas o días) (Silins y Högberg, 2011).
Por el contrario, en tejidos la detección refleja una exposición a más largo plazo. Siendo el hígado el órgano donde los residuos xenobióticos persisten durante más tiempo, resulta una matriz idónea para el análisis de residuos de micotoxinas.
TÉCNICA DE DETECCIÓN DE BIOMARCADORES DE MICOTOXINAS
La aparición en el mercado de técnicas de detección de biomarcadores de micotoxinas en hígado ha supuesto un gran avance para el control de las mismas.
A diferencia de lo que sucede en alimentos, la distribución de las micotoxinas en tejidos y fluidos biológicos es homogénea y, en consecuencia, su determinación no se ve afectada por errores de muestreo y proporciona información veraz del grado de exposición (Dragan et al., 2010).
1/ Tamaño de la muestra
2/ Recogida de la muestra . Las muestras se toman en granja o en matadero
3 / Parámetro evaluado
4/ Metodología usada
5/ Resultados obtenidos
Los resultados obtenidos son de gran ayuda tanto a nivel de granja como a nivel de fábrica de piensos, pues permiten:
MÁS CONTENIDOS DE Adiveter